
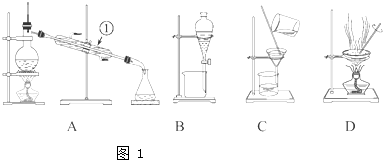
 如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: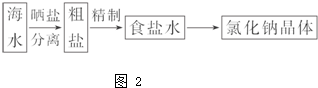


科目:高中化学 来源: 题型:
| CaO |
| △ |
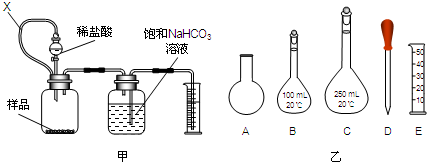
查看答案和解析>>
科目:高中化学 来源: 题型:
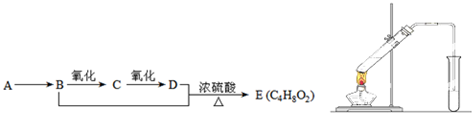
查看答案和解析>>
科目:高中化学 来源: 题型:
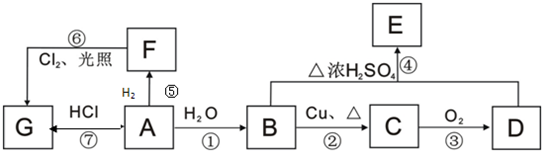
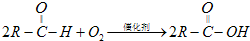 (R表示烃基),请回答下列问题:
(R表示烃基),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | HCl的酸性比H2CO3强 | 氯的非金属性大于碳 |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
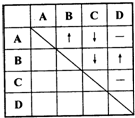 为了确定四瓶失去标签的五色溶液,它们分别是稀盐酸、稀硫酸、氢氧化钡和碳酸钠溶液,某同学采用了两两混合的方法.他能将四瓶溶液分别编号为A、B、C、D,然后各取少量在试管内两两混合,所观察到的现象如表中所示(“-”表示无明显现象;“↓”表示有沉淀生成:“↑”表示有气体生成.).
为了确定四瓶失去标签的五色溶液,它们分别是稀盐酸、稀硫酸、氢氧化钡和碳酸钠溶液,某同学采用了两两混合的方法.他能将四瓶溶液分别编号为A、B、C、D,然后各取少量在试管内两两混合,所观察到的现象如表中所示(“-”表示无明显现象;“↓”表示有沉淀生成:“↑”表示有气体生成.).查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 取久置的Na2O2粉末,向其中滴加过量的稀硫酸 | 产生无色气体 | Na2O2没有变质 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3.H2O能大量共存 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe2+>I2 |
| D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
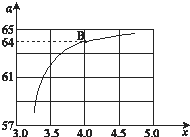 工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (g?CO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | a | B |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com