
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | HCl的酸性比H2CO3强 | 氯的非金属性大于碳 |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
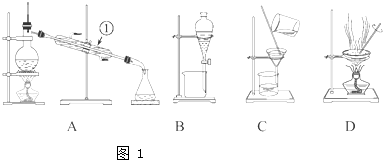 如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: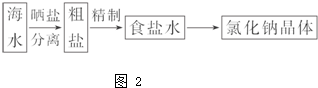
查看答案和解析>>
科目:高中化学 来源: 题型:
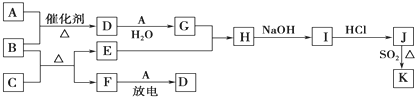
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②③④ |
| C、①③⑤ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系中混合气体的密度保持不变 |
| B、A、B、C的浓度相等 |
| C、单位时间生成n mol A,同时分解2n mol C |
| D、A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com