
 ;
;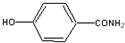 ;
;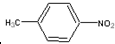 ;
;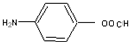 ,
, ;
; ;
; ;
; .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气 |
| B、氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气 |
| C、单质溴可以置换出碘,氯气又可以置换出溴 |
| D、氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
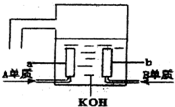
查看答案和解析>>
科目:高中化学 来源: 题型:
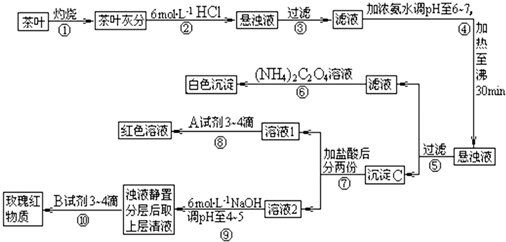
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
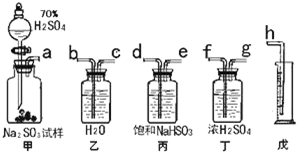 某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
| 操作1 | 沉淀质量 | Na2SO3%计算表达式 | |
| 甲 | 先往溶液中加入足量盐酸,再滴入足量BaCl2 | b克 | (1-142b/233a)×100% |
| 乙 | 先往溶液中加入足量Ba(NO3)2,再滴入足量盐酸 | c克 | (1-142c/233a)×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaO |
| △ |
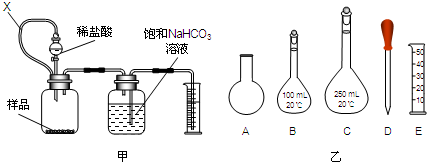
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为 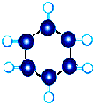 |
| C | ①由C、H、O三种元素组成: ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2; ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | HCl的酸性比H2CO3强 | 氯的非金属性大于碳 |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com