
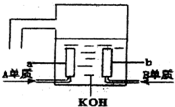


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、有多种元素符合本题条件 |
| B、符合本题的HxROy有一元酸和多元酸 |
| C、z与x的数值相等 |
| D、R可能是第二周期元素 |
查看答案和解析>>
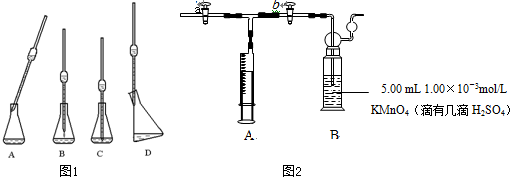
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
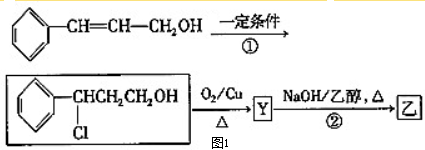
科目:高中化学 来源: 题型:
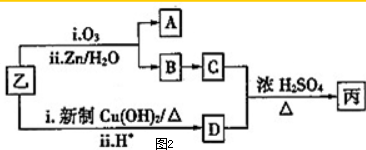
| i.O3 |
| ii.Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
滴定次数 | 用去NaOH溶液的体积 | ||
| 滴定前刻度 | 滴定后刻度 | 体积 (mL) | |
| 1 | 3.20 | 22.48 | |
| 2 | 1.23 | 20.55 | |
| 3 | 2.40 | 21.70 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com