
滴定次数 | 用去NaOH溶液的体积 | ||
| 滴定前刻度 | 滴定后刻度 | 体积 (mL) | |
| 1 | 3.20 | 22.48 | |
| 2 | 1.23 | 20.55 | |
| 3 | 2.40 | 21.70 | |
| 0.11mol/L×0.020L×5×60g/mol |
| 10.0g |
| c(NaOH)?V(NaOH) |
| V(CH3COOH) |
| 0.100mol/L×0.0193L |
| 0.020L |
| 0.11mol/L×0.020L×5×60g/mol |
| 10.0g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
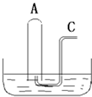 如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.
如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A、在RCl2中,各原子最外层均满足8电子的稳定结构 |
| B、元素L和N性质相似因为处于同一主族 |
| C、K、M、Q三元素最高价氧化物对应的水化物两两之间可发生化学反应 |
| D、氢化物沸点:H2Q>H2T |
查看答案和解析>>
科目:高中化学 来源: 题型:
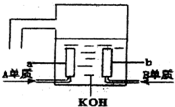
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HOCH2CH2COOCH2CH3 |
| B、HOCH2CH2CH2CH2COOH |
| C、CH3CH2CH(OH)CH2COOH |
| D、CH3CH(OH)CH2CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
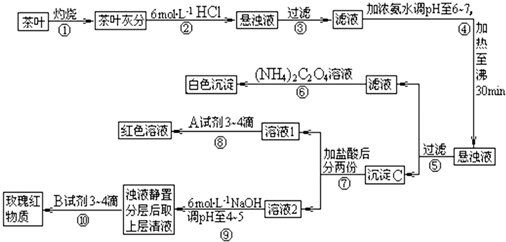
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaO |
| △ |
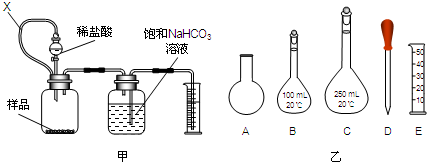
查看答案和解析>>
科目:高中化学 来源: 题型:
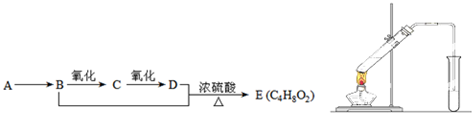
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com