
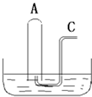
 如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.
如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.| n |
| V |
| 0.5amL×3 |
| 2 |
| a |
| 22.4 |
| ||
| 0.5L |
| a |
| 11200 |
| a |
| 11200 |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
| A、生铁和钢都是铁的合金 |
| B、生铁的含碳量一定比钢高 |
| C、生铁的韧性优于钢,所以生铁有着比钢更广泛的用途 |
| D、生铁和钢都不是纯铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,1mol水的体积是22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4L |
| D、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x等于6 |
| B、易溶于强酸和强碱 |
| C、用氧化物形式表示:BaO?CuO?2SiO2 |
| D、性质稳定,不易褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有多种元素符合本题条件 |
| B、符合本题的HxROy有一元酸和多元酸 |
| C、z与x的数值相等 |
| D、R可能是第二周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
滴定次数 | 用去NaOH溶液的体积 | ||
| 滴定前刻度 | 滴定后刻度 | 体积 (mL) | |
| 1 | 3.20 | 22.48 | |
| 2 | 1.23 | 20.55 | |
| 3 | 2.40 | 21.70 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com