
| 1 |
| 4 |
| 14g |
| 28g/mol |
| 1 |
| 4 |
| 14g |
| 28g/mol |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
276 112 |
| A、质量数为388 |
| B、中子数为276 |
| C、质子数为164 |
| D、电子数为112 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | C | ||||||
| D | E | F | G | ||||
| B | I | J | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
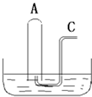 如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.
如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HOCH2CH2COOCH2CH3 |
| B、HOCH2CH2CH2CH2COOH |
| C、CH3CH2CH(OH)CH2COOH |
| D、CH3CH(OH)CH2CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com