
| 19.2g |
| 64g/mol |
| 2 |
| 8 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、Cu2+ H+ NO3- |
| B、K+ CO32- OH- |
| C、CO32- OH- NO3- |
| D、K+ H+ NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x等于6 |
| B、易溶于强酸和强碱 |
| C、用氧化物形式表示:BaO?CuO?2SiO2 |
| D、性质稳定,不易褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
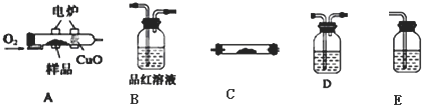
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②③ | C、①② | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+=Cu2++2H2O |
| C、金属铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、铜跟FeCl3溶液反应:Cu+2Fe3+=Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
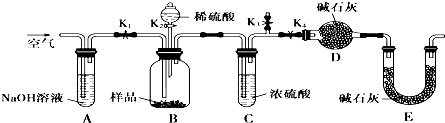
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com