
| 点燃 |
| 点燃 |


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
| A、铊是银白色,质软的金属 |
| B、铊位于第六周期第ⅢA族 |
| C、铊和稀硝酸反应生成Tl(NO3)3 |
| D、Tl(OH)3和Al(OH)3一样是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
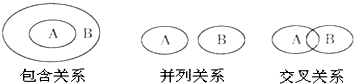
| A、纯净物与混合物属于包含关系 |
| B、化合物与电解质属于包含关系 |
| C、单质与化合物属于交叉关系 |
| D、氧化还原反应与化合反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
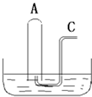 如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.
如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.查看答案和解析>>
科目:高中化学 来源: 题型:
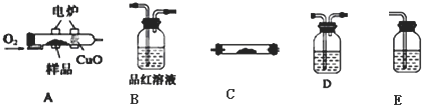
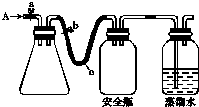 实验室用下列方法测定某水样中O2的含量.
实验室用下列方法测定某水样中O2的含量.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气 |
| B、氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气 |
| C、单质溴可以置换出碘,氯气又可以置换出溴 |
| D、氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com