
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A、在RCl2中,各原子最外层均满足8电子的稳定结构 |
| B、元素L和N性质相似因为处于同一主族 |
| C、K、M、Q三元素最高价氧化物对应的水化物两两之间可发生化学反应 |
| D、氢化物沸点:H2Q>H2T |


科目:高中化学 来源: 题型:
| A、x等于6 |
| B、易溶于强酸和强碱 |
| C、用氧化物形式表示:BaO?CuO?2SiO2 |
| D、性质稳定,不易褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+=Cu2++2H2O |
| C、金属铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、铜跟FeCl3溶液反应:Cu+2Fe3+=Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
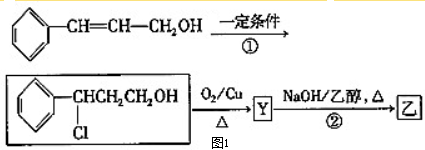
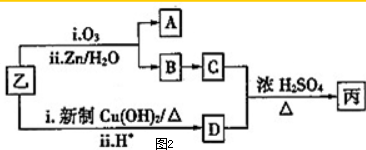
| i.O3 |
| ii.Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
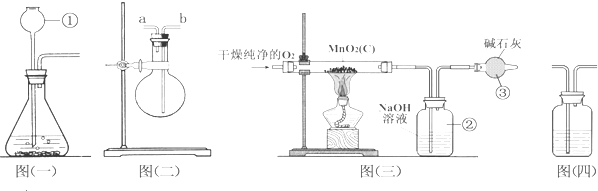
查看答案和解析>>
科目:高中化学 来源: 题型:
滴定次数 | 用去NaOH溶液的体积 | ||
| 滴定前刻度 | 滴定后刻度 | 体积 (mL) | |
| 1 | 3.20 | 22.48 | |
| 2 | 1.23 | 20.55 | |
| 3 | 2.40 | 21.70 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
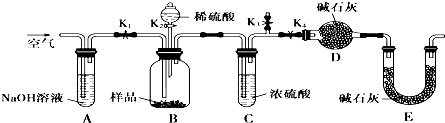
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究 (Ⅲ)实验①和④探究 |
| ② | 25 | 粗颗粒 | A | |
| ③ | B | 粗颗粒 | 2.00 | |
| ④ | 25 | 细颗粒 | 2.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com