
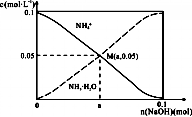
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 据电荷守恒可知在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 当n(NaOH)=0.1mol时,c(Na+)=c(NH4+)+c(NH3•H2O) | |
| D. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 |
分析 A.M点是向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离;
B.依据溶液中电荷守恒分析判断,n(Na+)=amol,n(Cl-)=1mol;
C.向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.1mol时,恰好反应生成氯化钠和一水合氨,依据 溶液中存在物料守恒分析判断;
D.铵根离子水解显酸性,结合水解平衡常数可知$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{Kh}{c(N{H}_{3}•{H}_{2}O)}$.
解答 解:A.M点是向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A正确;
B.在M点时溶液中存在电荷守恒,n(0H-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(0H-)-n(H+)=0.05+n(Na+)-n(Cl-)=(a-0.05)mol,故B正确;
C.向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.1mol时,恰好反应生成氯化钠和一水合氨,c(Na+)=c(Cl-),溶液中存在物料守恒,c(Na+)=c(Cl-)=c(NH4+)+c(NH3•H2O),故C正确;
D.铵根离子水解显酸性,结合水解平衡常数可知$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{Kh}{c(N{H}_{3}•{H}_{2}O)}$,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小,故D错误;
故选D.
点评 本题考查了酸碱反应过程分析,主要是溶液酸碱性、离子浓度大小,对水的电离影响因素分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.02mol•(L•min)-1 | B. | v(NH3)=0.01mol•(L•min)-1 | ||
| C. | v(N2)=0.01mol•(L•min)-1 | D. | v(H2)=0.03mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氡气是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡元素有222Rn、220Rn、219Rn三种同素异形体 | |
| D. | 氡的原子核外有6个电子层,最外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙酸和甲酸甲酯的混合物中含有共用电子对的数目是8×6.02×1023 | |
| B. | 等物质的量的-CH3与OH-所含电子数相等 | |
| C. | 7.8g Na2O2中所含阴离子的物质的量是0.2mol | |
| D. | 35C12和37C12互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com