
【题目】A、B、C、D、E是原子序数依次增大的前四周期元素。已知A元素基态原子的核外电子分占四个原子轨道;B元素基态原子的成对电子数是未成对电子数的6倍;C元素是同周期元素中电负性最大的元素;D元素基态原子的L层与M层的电子数相等,且与s能级的电子总数相等;E元素可与C元素形成2种常见化合物,其中一种为棕黄色,另一种为浅绿色。
请回答下列问题:
(1)E元素基态原子的价层电子排布式为________,属于________区的元素。
(2)A、B两元素的氧化物的晶体类型分别为________、________;写出B元素的最高价氧化物与HF溶液反应的化学方程式:_____________________________。
(3)元素A的一种氢化物是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,该分子中σ键和π键的数目分别为________和________。
(4)原子总数和价电子总数都相同的分子、离子或基团属于等电子体,由A~E中的元素形成的微粒中,与SO42-互为等电子体的分子是________(填分子式,任写一种),SO42-中的键角为________。
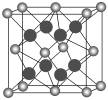
(5)D元素与最活泼的非金属元素形成的化合物的晶胞结构如图所示,其中“![]() ”代表的微粒是________(用元素符号或离子符号表示),该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________(写出表达式即可)。
”代表的微粒是________(用元素符号或离子符号表示),该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________(写出表达式即可)。
【答案】3d64s2 d 分子晶体 原子晶体 SiO2+4HF=SiF4↑+2H2O 5 1 SiCl4或CCl4 109°28′ F- ![]()
【解析】
A元素基态原子的核外电子分占四个原子轨道,则A是C元素;B元素基态原子的成对电子数是未成对电子数的6倍,则B是Si元素;C元素是同周期元素中电负性最大的元素,C是Cl元素;D元素基态原子的L层与M层的电子数相等,且与s能级的电子总数相等,则D是Ca元素;E元素可与C元素形成2种常见化合物,其中一种为棕黄色,另—种为浅绿色,则E是Fe元素,据此分析解答。
根据分析可知A为C元素,B为Si元素,C为Cl元素;D为Ca元素;E为Fe元素。
(1)E元素(Fe)基态原子的价层电子排布式为3d64s2,属于d区的元素;
(2) A、B两元素的氧化物分别是CO2是分子晶体,SiO2为原子晶体。SiO2与HF在溶液反应发生反应产生SiF4和H2O,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O。
(3)元素A的一种氢化物是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,该分子是乙烯,结构简式为H2C=CH2,在乙烯分子中含有5个σ键,1个π键;
(4)由“原子总数和价电子总数都相同的分子、离子或基团属于等电子体”可知,由A~E中元素形成的微粒中,与SO42-互为等电子体的分子有SiCl4、CCl4。
SO42-的中心原子S的杂化方式为sp3杂化,SO42-为正四面体结构,则SO42-中的键角为109°28′。
(5)D是Ca元素,钙元素与最活泼的非金属元素形成的化合物为CaF2,由题给晶胞图可知,“![]() ”微粒数为8×
”微粒数为8×![]() +6×
+6×![]() =4,“
=4,“![]() ”微粒数为8,黑球与灰球的个数比为2:1,则“
”微粒数为8,黑球与灰球的个数比为2:1,则“![]() ”代表的微粒是F-。在一个晶胞中含有4个CaF2,晶胞的质量为m=
”代表的微粒是F-。在一个晶胞中含有4个CaF2,晶胞的质量为m=![]() ,晶胞的密度为a g/cm3,则晶胞的体积为V=
,晶胞的密度为a g/cm3,则晶胞的体积为V=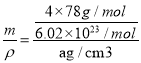 =
=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】烟气中含有大量氮氧化物NOx,工业脱硝技术成为研究热点。
(1)汽车尾气中NO和CO可利用车载催化剂转化为无毒物质排放。
已知:N2(g)+O2(g)=2NO(g) △H1=+183 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565 kJ·mol-1
写出催化转化的热化学方程式_________。
(2)臭氧氧化-碱吸收法可有效脱除NO,氧化原理为:NO(g)+O3(g)![]() NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
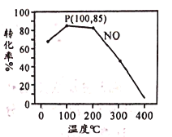
①100℃时,从开始反应到P点的平均反应速率v(NO)=__________。
②反应时同时发生副反应:2O3![]() 3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
(3)选择性催化还原技术(NCR)可在较低温度下脱硝,原理如图I,天然锰矿可作催化剂。
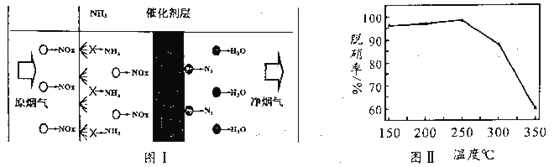
以NO代表氮氧化物,写出反应方程式_____________________;实验测得脱硝率随温度的变化如图II所示,请分析温度高于250℃时脱硝率下降的原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图所示),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
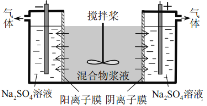
用惰性电极电解时,CrO42-能从浆液中分离出来的原因是_________________________,分离后含铬元素的粒子是__________,阴极室生成的物质为__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应:C6H12O6+6O2![]() 6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
A. 该生物燃料电池不可以在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C. 消耗1 mol氧气时转移4 mol e-,H+向负极移动
D. 今后的研究方向是设法提高葡萄糖生物燃料电池的效率,从而使其在将来可以为任何可植入医疗设备提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。下列叙述错误的是
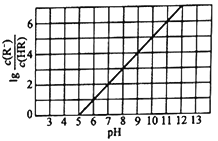
A. 25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B. 当通入0.1mol氨气时,c(NH4+)>c(R-)>c(OH-)>c(H+)
C. 当c(R-)=c(HR) 时,溶液为酸性
D. HR为弱酸,25℃时随着氨气的通入,c (R-)/[c(OH)c (HR)] 逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取FeCO3的工艺流程如下:
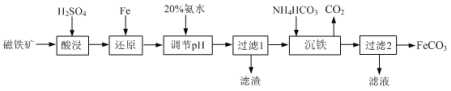
(1)“酸浸”时Fe3O4发生反应的离子反应方程式为 _______ 。
(2)“酸浸”过程中加入过量硫酸的目的是 _______ 和 _______ 。
(3)当溶液中金属离子浓度小于10-5mol·L-1时,则认为金属离子沉淀完全。若还原反应后溶液中c(Fe2+)=0.1 mol·L-1,则常温下加入20%氨水应调pH的范围为 _______ 。{已知:Ksp[Fe(OH)2]=1×10-17,Ksp[Al(OH)3]=1×10-32}
(4)“过滤1”所得滤渣除Fe、Al(OH)3外还有 _______ 。
(5)“沉铁”反应的离子方程式为: _______ 。
(6)若将“沉淀”试剂NH4HCO3改成Na2CO3,则溶液的混合方式为 _______ (填字母)。
A 向“过滤1”的滤液中滴加Na2CO3溶液,并充分搅拌
B 向Na2CO3溶液中滴加“过滤1”的滤液,并充分搅拌
C “过滤1”的滤液和Na2CO3溶液同时加入,并充分搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示。下列溶液中离子浓度关系正确的是
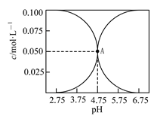
A.c(Na+)=0.1 mol·L-1的溶液中: c(H+)+c(CH3COOH)=c(OH-)
B.点A溶液中:c(Na+)>c(CH3COOH)
C.pH=3.5的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.c(CH3COO-)=0.025 mol·L-1的溶液中:3c(Na+)<c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
A.在此温度下液氨的离子积为1×10-17
B.在液氨中放入金属钠,可生成NaNH2
C.恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D.降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com