
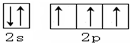
 (2)Cl
(2)Cl .
. 分析 (1)N原子的最外层5个电子,为2s22p3,为2s和2p电子,且2p轨道中应为3个单电子;
(2)Cl原子的最外层7个电子,为3s22p5,为3s和3p电子,且3p轨道中应为5个电子,1个单电子.
解答 解:根据洪特规则可知,电子排布时优先占据1个轨道,且自旋方向相同,
(1)N原子的最外层5个电子,为2s22p3,为2s和2p电子,且2p轨道中应为3个单电子,价电子轨道排布式为: ,
,
故答案为: ;
;
(2)Cl原子的最外层7个电子,为3s23p5,为3s和3p电子,且3p轨道中应为5个电子,1个单电子,其轨道排布式为: ,
,
故答案为: .
.
点评 本题考查原子核外电子排布,明确价电子是解答本题的关键,注意洪特规则的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定溶液的pH之前,要先用蒸馏水湿润 | |
| B. | 若用水湿润过的pH试纸去测定盐酸的pH,结果偏小 | |
| C. | 若用水湿润过的pH试纸去测定氢氧化钠溶液的pH,结果偏小 | |
| D. | 新制氯水呈酸性,所以只能使pH试纸变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S、H2O、HF的稳定性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次增强 | ||
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | D. | H2SiO3、H2CO3、H2SO4酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、苯、溴苯 | |
| B. | 用Ba(OH)2溶液鉴别硫酸钠和亚硫酸钠 | |
| C. | 用溴水鉴别甲烷和乙烯 | |
| D. | 通过烧焦时的特殊气味鉴别纯毛和纯棉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
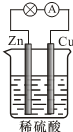
| A. | 负极的反应式为2H++2e-═H2↑ | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 反应一段时间后,溶液的酸性增强 | |
| D. | 硫酸既提供反应物,又起导电作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com