
分析 碳酸根离子水解显碱性,导致盐碱地产生碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,石膏能与碳酸根离子反应,平衡向左移动,OH-浓度降低,降低碱性,Na2CO3和CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠.
解答 解:碳酸根离子水解显碱性,导致盐碱地产生碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,石膏能与碳酸根离子反应,平衡向左移动,OH-浓度降低,降低碱性,石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠,硫酸根离子和钠离子不水解,则其溶液呈中性,所以石膏能降低其碱性,反应方程式为Na2CO3+CaSO4=Na2SO4+CaCO3↓,
故答案为:Na2CO3+CaSO4=Na2SO4+CaCO3↓.
点评 本题考查了盐类水解的原理和应用,水解平衡的影响因素判断,平衡移动方向的分析是解题关键,题目较简单.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 铝粉投入NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | AlCl3溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
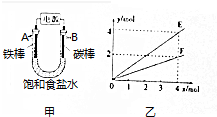
| A. | E表示反应生成NaOH的物质的量 | B. | E表示反应消耗H2O的物质的量 | ||
| C. | F表示反应生成H2或Cl2的物质的量 | D. | F表示反应消耗NaCl的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶解度减小 | B. | 溶液中溶质的质量分数变小 | ||
| C. | 溶剂的质量减小 | D. | 溶液变成不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将湿衣服放在太阳下晒干 | B. | 向较多粉尘的地面洒水后再清洁 | ||
| C. | 铁制栏杆喷涂油漆 | D. | 将食盐密封好,防止吸潮结块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| B. | 常温常压下,0.01mol Na2CO3含有的Na+离子数为 0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为 22.4L | |
| D. | 物质的量浓度为 0.5mol/L 的 MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通水泥 | B. | 普通玻璃 | C. | 汽车轮胎 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液变红 | |
| B. | Na2O与Na2O2组成元素相同、阴阳离子个数比相同,但跟水反应的产物不同 | |
| C. | 只存在共价键的物质一定是共价化合物、离子化合物中一定含有离子键 | |
| D. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com