
| A. | 0.1mol/L的盐酸溶液和0.1 mol/L的NaOH溶液 | |
| B. | pH=1的盐酸溶液和pH=13的Ba(OH)2溶液 | |
| C. | pH=4的醋酸溶液和pH=10的NaOH溶液 | |
| D. | pH=4的盐酸溶液和pH=10的NH3•H2O溶液 |
分析 A、根据盐酸和氢氧化钠都是强电解质,等物质的量的二者反应后溶液显示中性分析;
B、计算出硫酸、氢氧化钡中氢离子、氢氧根离子的浓度,根据二者都是强电解质判断;
C、根据醋酸是弱电解质,醋酸的浓度大于溶液中氢离子的浓度判断;
D、先计算出盐酸和氨水在氢离子、氢氧根离子浓度,再根据一水合氨为弱碱进行判断.
解答 解:A、0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液,等体积等浓度的二者恰好完全反应,溶液显示中性,pH=7,故A错误;
B、pH=1的硫酸中氢离子浓度为0.1mol/L,pH=13氢氧化钡溶液中氢氧根离子浓度为0.1mol/L,等体积二者混合,溶液中氢离子与氢氧根离子的物质的量相等,溶液显示中性,pH=7,故B错误;
C、pH=4的醋酸中氢离子浓度为1×10-4mol/L,pH=l0的氢氧化钠溶液中氢氧根离子浓度为1×10-4mol/L,由于醋酸是弱电解质,溶液中部分电离出氢离子,所以醋酸的浓度大于1×10-4mol/L,反应后醋酸过量,溶液显示酸性,pH<7,故C错误;
D、pH=4的盐酸中氢离子浓度为1×10-4mol/L,pH=l0的氨水中氢氧根离子浓度为1×10-4mol/L,由于一水合氨为弱碱,所以一水合氨的浓度大于1×10-4mol/L,反应后一水合氨过量,溶液显示碱性,溶液的pH大于7,故D正确;
故选D.
点评 本题考查酸碱混合的定性判断和计算,题目难度不大,注意把握酸碱的强弱以及溶液物质的量浓度的大小比较,试题培养了学生的分析、理解能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 中和10 mL 0.1 mol•L-1 醋酸与中和100 mL 0.01 mol•L-1的醋酸所需同种碱溶液的量不同 | |
| B. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在$\frac{{K}_{w}}{c(O{H}^{-})}$=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
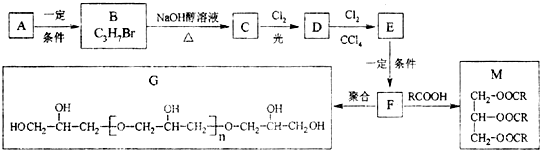
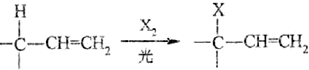
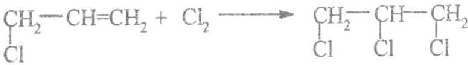 .
.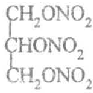 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液具有相同的性质:均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 只有胶状的物质如胶水、果冻类的才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠溶于水的反应:2Na+2H2O═2NaOH+H2↑ | |
| B. | 碳酸钠溶液和稀醋酸反应:CO2-3+2H+═H2O+CO2↑ | |
| C. | 向Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性:2H++SO2-4+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 硫化亚铁中加入稀硝酸:FeS+2H+═Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸 | B. | 乙二酸 | C. | 丙酸 | D. | 丁酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com