
【题目】根据所学知识完成下面小题:
(1)H2O2水溶液给称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,对下列A﹣C涉及H2O2的反应,填写下列空白:A、H2O2+Cl2═HCl+O2
B、H2O2+2I﹣+2H+═I2+2H2O
C、2H2O2 ![]() 2H2O+O2
2H2O+O2
D、CaO+H2O=Ca(OH)2
①H2O2仅体现氧化性的反应是(填代号,下同)
②H2O2既有氧化性又有还原性的是
③H2O2仅体现还原性的是
④H2O既无氧化性又无还原性的是
(2)已知CuO具有氧化性,能够与NH3反应生成两种单质和H2O,请写出在加热条件下CuO与NH3反应的化学方程式
(3)在一定条件下,RO ![]() 与Cl2反应如下:RO
与Cl2反应如下:RO ![]() +Cl2+2OH═RO
+Cl2+2OH═RO ![]() +2Cl+H2O由以上反应可知上述过程中RO
+2Cl+H2O由以上反应可知上述过程中RO ![]() 被(填“氧化”或“还原”),RO
被(填“氧化”或“还原”),RO ![]() 元素R的化合价是 .
元素R的化合价是 .
【答案】
(1)C;B;A;D
(2)3CuO+2NH3 ![]() N2+3Cu+3H2O
N2+3Cu+3H2O
(3)氧化;+4
【解析】解:(1)A、H2O2+Cl2=2HCl+O2↑中O元素化合价由﹣1价变为0价、Cl元素化合价由0价变为﹣1价,所以双氧水是还原剂,体现还原性;B、H2O2+2I﹣+2H+=I2+2H2O中O元素化合价由﹣1价变为﹣2价、I元素化合价由﹣1价变为0价,所以双氧水是氧化剂,体现氧化性;C、O2 ![]() 2H2O+O2↑中O元素化合价由﹣1价变为0价、﹣2价,所以双氧水既是氧化剂又是还原成,所以体现氧化性和还原性,D、CaO+H2O=Ca(OH)2水中各元素的化合价未变,所以H2O既无氧化性又无还原性;①H2O2仅体现氧化性的是C,故选C;②H2O2既有氧化性又有还原性的是B;③H2O2仅体现还原性的是A;④H2O既无氧化性又无还原性的是D;(2)加热条件下,CuO具有氧化性,能够与NH3反应生成两种单质和H20,该反应中Cu得电子化合价降低生成Cu、氨气中N元素失电子化合价升高生成氮气,反应方程式为3CuO+2NH3
2H2O+O2↑中O元素化合价由﹣1价变为0价、﹣2价,所以双氧水既是氧化剂又是还原成,所以体现氧化性和还原性,D、CaO+H2O=Ca(OH)2水中各元素的化合价未变,所以H2O既无氧化性又无还原性;①H2O2仅体现氧化性的是C,故选C;②H2O2既有氧化性又有还原性的是B;③H2O2仅体现还原性的是A;④H2O既无氧化性又无还原性的是D;(2)加热条件下,CuO具有氧化性,能够与NH3反应生成两种单质和H20,该反应中Cu得电子化合价降低生成Cu、氨气中N元素失电子化合价升高生成氮气,反应方程式为3CuO+2NH3 ![]() N2+3Cu+3H2O,所以答案是:3CuO+2NH3
N2+3Cu+3H2O,所以答案是:3CuO+2NH3 ![]() N2+3Cu+3H2O;(3)该反应中Cl元素化合价由0价变为﹣1价,所以氯气是氧化剂,则RO
N2+3Cu+3H2O;(3)该反应中Cl元素化合价由0价变为﹣1价,所以氯气是氧化剂,则RO ![]() 是还原剂被氧化,根据电荷守恒得n=2,则RO
是还原剂被氧化,根据电荷守恒得n=2,则RO ![]() 中R元素化合价=6﹣2=+4,所以答案是:氧化;+4.
中R元素化合价=6﹣2=+4,所以答案是:氧化;+4.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1 , △S=+133.7J(Kmol)﹣1
①该反应能否自发进行与有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变 b.1molH﹣H键断裂的同时断裂2molH﹣O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为 .
②该反应的逆反应为(填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是(用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJmol﹣1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2 , 下列措施中能使c (CH3OH)增大的是 .
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3molH2 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法不正确的是

A. 阳极反应为4OH-4e-=2H2O+O2↑ B. 通电后阴极区附近溶液pH会增大
C. 纯净的KOH溶液从a出口导出 D. K+通过交换膜从阳极区移向阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:2MnO ![]() +5C2O
+5C2O ![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
B.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO ![]() +2Ba2++5OH﹣=2BaSO4↓+NH3?H2O+AlO
+2Ba2++5OH﹣=2BaSO4↓+NH3?H2O+AlO ![]() +2H2O
+2H2O
C.NaHSO3溶液与FeCl3反应的离子方程式:SO ![]() +2Fe3++H2O=SO
+2Fe3++H2O=SO ![]() +2Fe2++2H+
+2Fe2++2H+
D.NH4HCO3溶液中加入少量NaOH:NH4++OH﹣═NH3?H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
(1)基态Ni的外围电子排布式为
(2)比较C、N、Al的第一电离能(用元素符号表示)
(3)比较Cu、Al、C的最高价氧化物的沸点由高到低顺序为(用化学式表示)
(4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式
(5)Ni为电池中常见的材料,以Al和NiOOH为电极,NaOH为电解液组成电池,放电时NiOOH转化为Ni(OH)2写出电池的总反应
(6)Ca和F形成的某离子晶体结构如图所示,Ca2+的配位数为 . 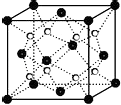
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,RO﹣与R﹣可发生反应:RO ![]() +5R﹣+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R﹣+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A.元素R位于周期表中第ⅤA族
B.RO ![]() 中的R只能被还原
中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO ![]() 参与该反应,则转移的电子的物质的量为5 mol
参与该反应,则转移的电子的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( ) 
A.用装置甲制取氯气
B.用装置乙除去氯气中混有的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl24H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015秋湖州期末)某无色透明的溶液,在强酸性和强碱性的条件下都能大量共存的是( )
A.Fe2+、K+、SO42﹣、HCO3﹣ B.Mg2+、Na+、SO42﹣、Cl﹣
C.Na+、K+、SO42﹣、NO3﹣ D.Ba2+、Na+、MnO4﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com