
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1) D元素在周期表中的位置是________,中子数为14的E原子可表示为________。
(2)写出由A和C形成的化合物的化学式 ,该化合物由 键形成。
(3) A、B、C、D、E五种元素的离子半径由小到大的顺序是________(用离子符号填写)。
(4)写出实验室制取A的气态氢化物的化学方程式:________________________________。
(5)简述比较D与E金属性强弱的实验方法:_____________________。
【答案】(1)第三周期第ⅡA族;第三周期第ⅡA族 (2) Na3N;离子 (3) Al3+<Mg2+<Na+<O2-<N3-(4) 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(5)镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应(其他答案合理也可)
【解析】试题分析:A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙,则B是O,C是Na。A原子的最外层电子数比次外层电子数多3个,因此A是N。E是地壳中含量最高的金属元素,则E是Al,因此D是Mg。
(1)镁元素的原子序数是12,在周期表中的位置是第三周期第ⅡA族,中子数为14的E原子可表示为第三周期第ⅡA族。
(2)由A和C形成的化合物是氮化钠,化学式为Na3N,该化合物由离子键形成。
(3)A、B、C、D、E五种元素的离子具有相同的核外电子排布,离子半径随原子序数的增大而减小,则半径由小到大的顺序是Al3+<Mg2+<Na+<O2-<N3-。
(4)实验室制取A的气态氢化物氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(5)镁能与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应,这说明镁的金属性强于铝。


科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N(g)+3H2(g)![]() 2NH3(g),在20℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是()
2NH3(g),在20℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是()

A.点a的正反应速率比b 的小
B.点c处反应达到平衡
C.点d(t2时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,该反应在25℃下反应达到平衡状态,所用的时间比原来的少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:

回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________。
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。
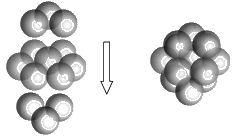
①每个Fe2+周围最近的等距离的S22-离子有____________个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为 。
(2)某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48 L,通入足量的溴水,溴水质量增加2.8 g,此两种烃的组成为 (填分子式)。
(3)某烃是一种比水轻的油状液体,相对分子质量为78,碳元素与氢元素的质量比为12:1,不能使溴水和酸性高锰酸钾溶液褪色。写出此烃发生取代反应的化学方程式(任意写一个即可) 。
(4)2.3g某有机物A完全燃烧后,生成0.1 mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,已知此有机物可以发生催化氧化反应,写出此反应的化学方程式 。
(5) 有机物的结构可用“键线式”表示,如:![]() 可简写为
可简写为![]()
![]() 可简写为
可简写为 ![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,
。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,![]() ,苧烯的分子式为 。
,苧烯的分子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是生物体的一种代谢产物,菠菜、苋菜等植物中富含草酸,但在人体中容易与钙离子形成草酸钙导致肾结石。某化学研究小组为了研究草酸,查阅资料获取了以下信息。
① 草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易升华,易溶于水。
② 草酸晶体受热脱水,170℃以上分解产生CO、CO2和H2O。
③ 草酸为二元酸:K1=5.4×10-2,K2=5.4×10-5。
④ 草酸的钠盐和钾盐易溶于水。
(1)研究小组为了验证草酸受热分解产生的CO2,按照如下图所示的装置进行实验。装置B中可观察到的现象是 。但研究小组指导老师认为实验方案欠妥,要求改进实验。小组同学一致同意在A、B之间再加入一个实验装置C,其作用是 ,请在下图方框中画出该装置,并标明所需试剂。

(2)研究小组为了验证草酸受热分解产生的CO,按照(1)实验中的装置A、C和下图所示的部分装置(可以重复选用)进行实验。

实验装置依次连接的合理顺序为A→C→ →H→D→I。装置H反应管中盛有的物质是 。
(3)经过实验(1)和(2)证明草酸晶体受热分解产生了CO和CO2。请写出草酸晶体受热分解的化学方程式 。
(4)为了测定某草酸溶液的物质的量浓度,该小组查阅文献发现硫酸酸化的高锰酸钾溶液可以氧化草酸并放出CO2,反应的离子方程式为 。若利用已知浓度的酸性高锰酸钾标准液滴定未知浓度的草酸溶液,滴定终点判断方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。请填写以下空白:

(1)A中含有的化学键是________。
(2)写出铜与J反应制取H的化学方程式:__________________________________________。
(3)写出反应③的离子方程式:_________________________________________。
(4)写出物质B的电子式:_______________;写出物质E的电子式:_______________。
(5)在反应④中,当生成标况下22.4 L 物质G时,转移电子数为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉·坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就。屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法。右图为青蒿素,关于该物质的下列说法正确的是

A.青蒿素化学式为C15H20O5
B.在光照条件下可能发生取代反应
C.可以与氢气发生加成反应
D.水浸青蒿对治疗疟疾有良好的疗效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
温度(K) | 平衡时NH3的物质的量(mol) |
T1 | 2.4 |
T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量(![]() )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。

(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。

①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y小,X与W同主族,Z是地壳中含量最高的元素。X、Y、Z、W原子最外层电子数之和为13。问:
(1)X是 Y是 Z是 W是 (填元素符号)
(2)写出W的最高价氧化物对应的水化物的电子式 ,写出Y的简单氢化物的电子式 。
(3)Y的最高价氧化物对应的水化物的浓溶液久置后呈现黄色,写出发生反应的化学方程式 。
(4)实验室制取Y的氢化物的方程式 ,该反应 (填“是”或“不是”)氧化还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com