
【题目】下列现象与氢键有关的是( )
①![]() 的熔、沸点比
的熔、沸点比![]() 的高
的高
②乙醇能与水以任意比混溶,而乙硫醇(![]() )微溶于水
)微溶于水
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤![]() 比
比![]() 稳定
稳定
⑥接近沸点的水蒸气的相对分子质量测量值大于实际值
A.①②③④⑥B.①②③④⑤C.②③④⑤D.①②③④⑤⑥
【答案】A
【解析】
![]() N的非金属性强于P,
N的非金属性强于P,![]() 分子之间存在氢键,熔化和气化时,除克服分子间作用力外,还需克服氢键,导致
分子之间存在氢键,熔化和气化时,除克服分子间作用力外,还需克服氢键,导致![]() 的熔、沸点比PH3高,
的熔、沸点比PH3高,![]() 正确;
正确;![]() 乙醇与水分子之间能形成氢键,可以和水以任意比互溶,硫醇(
乙醇与水分子之间能形成氢键,可以和水以任意比互溶,硫醇(![]() )与水之间不能形成氢键,在水中的溶解性小得多,
)与水之间不能形成氢键,在水中的溶解性小得多,![]() ;
;![]() 冰中存在氢键,增加了分子之间的距离,其体积变大,则相同质量时冰的密度比液态水的密度小,
冰中存在氢键,增加了分子之间的距离,其体积变大,则相同质量时冰的密度比液态水的密度小,![]() 正确;
正确;![]() 对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,与氢键有关,
对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,与氢键有关,![]() 正确;
正确;![]() H-O键键能比H-S键大,故
H-O键键能比H-S键大,故![]() 比
比![]() 更难分解,与氢键无关,
更难分解,与氢键无关,![]() 错误;
错误;
![]() 由于水分子之间存在氢键,使水分子通常以几个分子聚合的形式存在,所以用测接近沸点的水蒸气的相对分子质量测定值比用化学式
由于水分子之间存在氢键,使水分子通常以几个分子聚合的形式存在,所以用测接近沸点的水蒸气的相对分子质量测定值比用化学式![]() 计算出来的相对分子质量大,
计算出来的相对分子质量大,![]() 正确;
正确;
综上所述,①②③④⑥均与氢键有关。
答案选A。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaF溶液中F-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有容积均为2 L的甲、乙恒容密闭容器,向甲中充入1.5 mol CO2和3 mol H2,乙中充入2 mol CO2、3 mol H2,一定条件下仅发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是

A.该反应的ΔH>0
B.曲线Ⅱ表示甲容器中CO2的平衡转化率与温度的关系
C.500 K时,该反应的化学平衡常数为200
D.700 K时,若在上述密闭容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,则达到平衡时,H2的体积分数大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、NOx、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(l)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。已知:
![]() ①
①
![]() ②
②
则反应![]() (1)△H=_______
(1)△H=_______
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:
①在一定温度条件下,向2L恒容密闭容器中加入2 mol CH4和2 mol NH3,平衡时NH3体积分数为30%,所用时间为10 min,则该时间段内用CH4的浓度变化表示的反应速率为______ mol·L-l·min-1,该温度下平衡常数K= ___。若保持温度不变,再向容器中加入CH4和H2各1 mol,则此时v正 ___(填“>”“=”或“<”)v逆 。
②其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图1所示。X代表 ___(填字母代号)。
A 温度 B 压强 C 原料中CH4与NH3的体积比
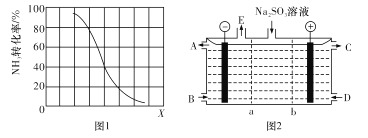
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨。A--E分别代表生产中的原料或产品,b表示____(填“阴”或“阳”)离子交换膜。阳极的电极反应式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为Li1-xCoO2+LixC6![]() LiCoO2+C6(x<l)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸,工作原理如图所示(注明:酸化电解后的苯甲酸盐可以析出苯甲酸)。
LiCoO2+C6(x<l)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸,工作原理如图所示(注明:酸化电解后的苯甲酸盐可以析出苯甲酸)。
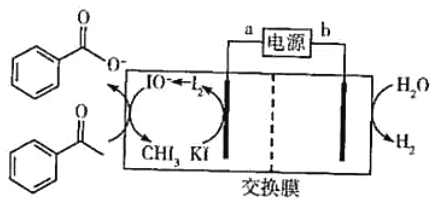
下列说法正确的是( )
A.锂离子电池的a极为负极
B.放电时,正极反应式为xLi++xe-+Li1-xCoO2=LiCoO2
C.交换膜为质子交换膜
D.每产生4.48LH2(标准状况),生成0.4molIO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
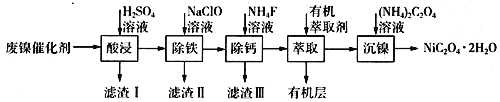
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
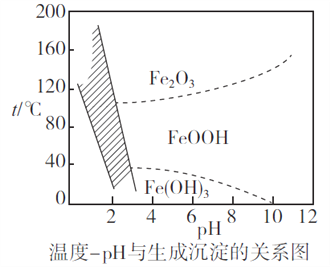
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。
(1)NH3 是一种很好的配体,氨气分子是_____(填“极性”或“非极性”)分子,NH3 的沸 点_____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:

图中虚线表示的作用力为_________________________。
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是_____________,其中心原子的杂化轨道类型是________________ 。
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于_____________________ (填编号)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铅蓄电池放电时,负极质量减轻,正极增重
B.升高CH3COONa溶液的温度,其水的离子积常数和pH均增大
C.CH3CH=CHCH3分子中的四个碳原子都在一条直线上
D.常温下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,则S(AgBr)>S(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com