
实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是( )
A.加入明矾,使海水的盐分沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化
科目:高中化学 来源: 题型:
有下列有机反应类型:①消去反应,②水解反应,③加聚反应,④加成反应,⑤还原反应,⑥氧化反应。以丙醛为原料制取1,2丙二醇,所需进行的反应类型依次是( )
A.⑥④②① B.⑤①④②
C.①③②⑤ D.⑤②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g) 2H2(g)+O2(g) ΔH=484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是
A.前20 min内的反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H22NH3是工业上合成氨的重要反应。

(1)根据图1请写出合成氨的热化学方程式__________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1~t6”表示)。
(3)t3时刻改变的条件是____________,t5时刻改变的条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上冶炼金属,常用的方法有四种:Ⅰ.热分解法,Ⅱ.热还原法,Ⅲ.电解法,Ⅳ .湿法冶金,下表中金属与常用冶炼方法相符的是( )
.湿法冶金,下表中金属与常用冶炼方法相符的是( )
| 金属 | 冶炼方法 | |
| A | 钾、钙 | Ⅳ |
| B | 钠、铝 | Ⅲ |
| C | 铜、铁 | Ⅰ |
| D | 银、汞 | Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.①②④ B.①②⑥ C.②⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是 ( )
A.线段BC代表Fe3+ 物质的量的变化情况
B.原混合溶液中n(FeBr2)= 6mol
C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━
D.原溶液中n(Fe2+): n(I━): n(Br━)=2:1:3
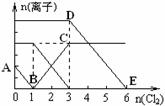
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com