
| A. | 用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路 | |
| B. | 大雾天气用汽车远光灯照射前方常出现明亮光路 | |
| C. | 明矾可用作净水剂 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
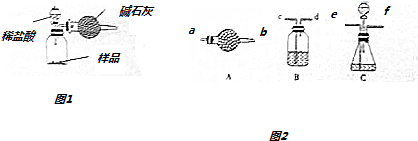
| 选用的仪器 | |||||
| 添加的药品(或必要的操作) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 目 的 | 化学试剂及方法 | 供选择的化学试剂及方法 A.加入硝酸酸化的硝酸银溶液 B.加入食醋,加热 C.灼烧、闻气味 D.加入新制氢氧化铜悬浊液,加热 E.将样品滴在淀粉碘化钾试纸上 |
| 除去热水瓶中的水垢 | ||
| 鉴别蔗糖和葡萄糖 | ||
| 验证味精中是否含有食盐 | ||
| 区别毛织物和棉织物 | ||
| 检验自来水是否含Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| C. | 0.5mol/L AlCl3溶液中Cl-的数目为1.5NA | |
| D. | 17g氨气中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g O2 | B. | 0.3mol NaCl | ||
| C. | 标准状况下4.48L CH4 | D. | 含有3.01×1022个氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫 | B. | 盖斯 | C. | 勒夏特列 | D. | 范德华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
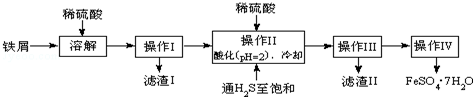
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com