
【题目】向含有水分的蔗糖中缓慢注入浓硫酸,不能显示浓硫酸的
A.酸性B.吸水性C.脱水性D.氧化性
科目:高中化学 来源: 题型:
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路,下列叙述正确的是( )
后,使c、d两点短路,下列叙述正确的是( )

A. a为直流电源的负极
B. f电极为锌板
C. c极发生的反应为2H++2e-=H2↑
D. e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校化学实验室欲用NaOH固体配制1.0molL﹣1的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其正确的操作顺序为 . 本实验必须用到的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管等外,还需要的仪器有 .
(2)某同学欲称量NaOH固体,他先用托盘天平称量、烧杯的质量,天平平衡后的状态如图所示.烧杯的实际质量为 g,要完成本实验该同学应称取 g NaOH.
(3)使用容量瓶前必须进行的一步操作是 .
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏大的是
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀静置后,液面低于刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金刚石的晶体结构中含有由共价键形成的碳原子环,其中最小的环上的碳原子数及每个碳原子上任意两个C—C键间的夹角分别是( )
A.6、120°B.5、108°C.4、109.5°D.6、109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙炔的实验装置图(如图)中,
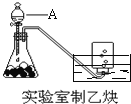
(1)A仪器的名称为_________________;所盛的试剂为_________________;发生反应的化学方程式为:__________________________________________________;
(2)将反应产生的乙炔通入酸性高锰酸钾溶液中,观察到的现象是:_________________;将反应产生的乙炔通入溴的四氯化碳溶液中,反应的化学方程式为:__________________________________;(产物为1,2-二溴乙烯)
(3)生成的乙炔中可能含有的杂质气体是_________________,除去的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于N2和CO的叙述正确的是 ( )
A. 28g两者混合物含有2mol原子 B. 同温度、同压的N2和CO密度之比为1:2
C. 同温度、同体积时两者质量相等 D. 同压强、同体积时两者分子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W、N六种元素的原子序数依次增大,其中X、Y、Z、M、W为五种短周期元素。X元素的某种核素无中子,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。N是用量最多的金属元素。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. N的一种氧化物可用作油漆和涂料
C. 热稳定性:XM>X2Z
D. X2Z、WM4分子中各原子最外层均为8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素有①构成物质的粒子数;②粒子大小;③粒子间的距离.对固体、液体物质而言,它主要是由上述决定(填写编号,下同);对气体物质而言,它主要由上述决定.上述三种因素中,与外界条件有关的是 .
(2)配制100mL2molL﹣1的 H2SO4溶液,需要某98%H2SO4溶液(密度为1.8g/cm﹣3)的体积为﹣﹣﹣﹣mL;需要的仪器有量筒、玻璃棒、胶头滴管、烧杯和;若配制溶液时,玻璃棒和烧杯未洗干净,则所配溶液的浓度;取配制后的溶液10mL,加入足量的锌,则生成标况下氢气的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:________________________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:_____________ 钛极附近的pH值________ (增大、减小、不变)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:____________。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2+O2 ΔH>0
2H2+O2 ΔH>0
水蒸气的浓度随时间t变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.0500 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.1000 | 0.0940 | 0.0900 | 0.0900 | 0.0900 | 0.0900 |
①对比实验的温度T2_____ T1(填“>”“<”或“=”)。
②实验①前20 min的平均反应速率v(O2)=______。
③催化剂催化效率:实验①______实验② (填“>”、“<")。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com