
A.Na2CO3(s) B.水
C.K2SO4(aq) D.(NH4)2SO4(s)
科目:高中化学 来源: 题型:阅读理解
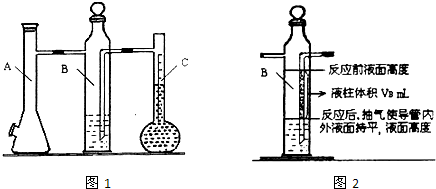
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
查看答案和解析>>
科目:高中化学 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
“实验化学”
为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究.
[实验原理]有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量.
[实验用品]2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5% KSCN溶液、pH=4的HAc-NaAc缓冲溶液、1∶1 HNO3溶液、复方硫酸亚铁药片.
铁架台(铁夹)、100 mL容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉网、酒精灯、玻璃棒、25 mL比色管、pH试纸.
[实验过程]
(1)配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL 5%KSCN溶液和2.5 mL pH=4的HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度.
(2)制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,加入2 mL蒸馏水溶解,再加入2 mL 1∶1 HNO3溶液,小心加热2~3 min.冷却后,全部移入100 mL容量瓶中,再加入4.0 mL 5%KSCN溶液和10.0 mL pH=4的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL.取25.00 mL待测液加入与(1)相同规格的比色管中.
(3)比色:将(2)所得比色管中的溶液与(1)各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围.
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显________色.
(2)完成该实验,还缺少的仪器有________、________.
(3)加入pH=4的HAc-NaAc缓冲溶液的目的是________.
(4)实验中量取 HNO3溶液、HAc-NaAc缓冲溶液量筒即可,原因是________.
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是________.
(6)若测得待测液中Fe3+的物质的量浓度为cmol/L,药片的质量为m,则药片中铁元素的质量分数为________.
查看答案和解析>>
科目:高中化学 来源:江苏省通州市石港中学2008届高三化学科预测卷 题型:058
实验化学:
2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨.某校研究性学习小组拟对本市空气中二氧化硫含量(mg·m-3)进行测定.经查阅资料可用以下方法测定:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫与副玫瑰苯胺、甲醛作用,生成紫红色化合物.据其颜色深浅,用分光光度计在577 nm处进行测定.
分光光度计是利用分光光度法对物质进行定量定性分析的仪器.而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析.其工作原理可以简单的用公式表示为A=KC,其中A为吸光度,K为一定条件下的常数,C为溶液浓度.
实验步骤:(1)采样:
①如果你是该兴趣小组成员,你对采样的地点和时间有何建议:
___________________________________
②用如图装置采样,通过50 L空气后,将吸收液移入100 ml容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用.
用多孔球泡而不用导管的原因是____________________________.
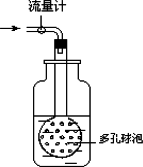
(2)吸光度与SO2含量标准曲线的绘制:在6支25 ml比色管中,用每毫升含25 μg二氧化硫的标准液配置下表标准SO2含量系列.
二氧化硫标准系列

用10 mL比色皿,以水为参比,测定各管吸光度,实验结果如下.

以吸光度值为纵坐标,二氧化硫含量(μg/10 mL)为横坐标,绘制标准曲线
(3)准确量取容量瓶中溶液10 mL加入比色皿,测得其吸光度值为0.10,则空气中二氧化硫含量为________mg·m-3.我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3):一级标准:0.15二级标准:0.50三级标准:0.70.则该市空气为________级标准.
(4)甲、乙两组同学测定结果相差较大,乙组同学测定空气中SO2含量偏小,试分析乙组同学出现误差的可能原因:(两个所用药品和装置均无问题)
_______________________________________
(5)请你提出江苏防治酸雨的两条主要措施:
_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08 mg/m![]() 。可利用酸性高锰酸钾溶液测定甲醛含量。
。可利用酸性高锰酸钾溶液测定甲醛含量。
测定原理:KMnO4 (H![]() )溶液为强氧化剂,可氧化甲醛和草酸。
)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为: 4MnO4—+5HCHO+12H+ ![]() 4Mn2++5CO2↑+11H2O
4Mn2++5CO2↑+11H2O
2MnO4—+5H2C2O4+6H+ ![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
 |
测定装置:部分装置如右图所示(a、b为止水夹)。
测定步骤:
①收集待检新装修的房屋居室空气5 L。
②准确量取5.00 mL 1.00×10![]() mol/L的高锰酸
mol/L的高锰酸
钾溶液于250 mL锥形瓶中,滴入3滴6 mol/L
的H![]() SO
SO![]() 溶液,加水45 mL稀释,备用。
溶液,加水45 mL稀释,备用。
③将1.00×10![]() mol/L的草酸标准溶液置于酸式滴定管中备用。
mol/L的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
回答以下问题:
(1)使用_________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低? 。
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
。
(4)计算该居室内空气中甲醛的浓度_________mg/m![]() ,该居室的甲醛________(填“是”或“否”)超标。
,该居室的甲醛________(填“是”或“否”)超标。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(10分)已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08 mg/m![]() 。可利用酸性高锰酸钾溶液测定甲醛含量。
。可利用酸性高锰酸钾溶液测定甲醛含量。
测定原理:KMnO4 (H![]() )溶液为强氧化剂,可氧化甲醛和草酸。
)溶液为强氧化剂,可氧化甲醛和草酸。
![]() 有关离子方程式为: 4MnO4—+5HCHO+12H+ 4Mn2++5CO2↑+11H2O
有关离子方程式为: 4MnO4—+5HCHO+12H+ 4Mn2++5CO2↑+11H2O
![]() 2MnO4—+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
2MnO4—+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
 |
测定装置:部分装置如右图所示(a、b为止水夹)。
测定步骤:
①收集待检新装修的房屋居室空气5 L。
②准确量取5.00 mL 1.00×10![]() mol/L的高锰酸
mol/L的高锰酸
钾溶液于250 mL锥形瓶中,滴入3滴6 mol/L
的H![]() SO
SO![]() 溶液,加水45 mL稀释,备用。
溶液,加水45 mL稀释,备用。
③将1.00×10![]() mol/L的草酸标准溶液置于酸式滴定管中备用。
mol/L的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
回答以下问题:
(1)使用_________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低? 。
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
。
(4)计算该居室内空气中甲醛的浓度_________mg/m![]() ,该居室的甲醛________(填“是”或“否”)超标。
,该居室的甲醛________(填“是”或“否”)超标。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com