
【题目】在某一容积为 2L 的恒容密闭容器中,A、B、C、D 四种气体物质发生可逆反应,其物质的量 n(mol)随时间 t(min)的变化曲线如图所示。回答下列问题:
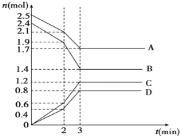
(1)该反应的化学方程式为____。
(2)前 2min 内用 A 的浓度变化表示的化学反应速率为____;
(3)在 2min 时,图象发生改变的原因可能是_____ (填字母)
A.增大 B 的物质的量 B.降低温度 C.加入催化剂 D.减小 A 的物质的量
(4)不同条件下的该反应的速率:①v(A)=1.0mol·L-1·s-1,②v(B)=1.0 m ol·L-1·s-1,③v(C)=1.2 mol·L-1·s-1,④v(D)=1.2mol·L-1·s-1。其中反应速率最快的是___ (填序号)。
【答案】4A+5B6C+4D 0.1mol/(L·min) C ④
【解析】
根据图象知,A、B物质的量减少是反应物、C和D物质的量增加是生成物,根据各物质物质的量的变化量之比等于其计量数之比,据此书写方程式,注意反应物未完全转化为生成物,此反应为可逆反应;用反应速率等于浓度的变化除以时间,求出A的反应速率;外界条件能改变反应速率,根据图形进行分析;比较反应速率的快慢根据反应速率之比等于化学计量数之比,把不同物质转化为同一物质进行比较。
(1)根据图象知,A、B物质的量减少是反应物、C和D物质的量增加是生成物,反应达到平衡时,各物质的物质的量变化量分别为:△n(A)=(2.51.7)mol=0.8mol、△n(B)=(2.41.4)mol=1.0mol、△n(C)=(1.20)mol=1.2mol、△n(D)=(0.80)mol=0.8mol,
物质的物质的量的变化量之比等于其计量数之比,所以A、B、C、 D计量数之比=0.8mol:1.0mol:1.2mol:0.8mol=4:5:6:4,反应方程式为4A+5B6C+4D;
(2)化学反应速率等于浓度的变化除以时间,前2min内用A的浓度变化表示的化学反应速率v(A)![]() ;
;
(3)在2min时,各物质的物质的量不变,故A、D不选,相同时间内物质的量变化量增大,说明加快了反应速率,降低温度反应速率减慢,B不选,只有加入催化剂能加快反应速率且瞬间各物质的物质的量不变,故答案选C;
(4) 根据反应速率之比等于化学计量数之比(4A+5B6C+4D),把不同物质转化为同一物质进行比较,如全转化为A:①v(A)=1.0mol·L-1·s-1,②v(A)=![]() ×v(B)=
×v(B)=![]() ×1.0 mol·L-1·s-1=0.8 mol·L-1·s-1,③v(A)=
×1.0 mol·L-1·s-1=0.8 mol·L-1·s-1,③v(A)=![]() ×v(C)=
×v(C)=![]() ×1.2 mol·L-1·s-1=0.8 mol·L-1·s-1,④v(A)=v(D)=1.2mol·L-1·s-1,比较数值可知其中反应速率最快的是④。
×1.2 mol·L-1·s-1=0.8 mol·L-1·s-1,④v(A)=v(D)=1.2mol·L-1·s-1,比较数值可知其中反应速率最快的是④。


科目:高中化学 来源: 题型:
【题目】I.下列物质
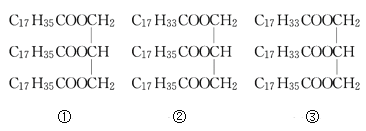
(1)属于简单甘油酯的是(填序号,下同)____,属于混合甘油酯的是______。
(2)①发生皂化反应的化学方程式为________。
Ⅱ.完成银镜反应实验:在AgNO3溶液中逐滴加入氨水,开始时在AgNO3溶液中出现白色沉淀,反应的离子方程式为_____,继续滴入氨水至沉淀溶解,反应的化学方程式为____,边滴边振荡直滴到______为止。再加入乙醛溶液后,水浴加热现象是____,化学方程式为:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类非常重要的反应。回答下列问题:
(1)按如图所示操作,充分反应后:
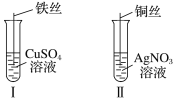
①Ⅰ中发生反应的离子方程式为__________________________________;
②Ⅱ中铜丝上观察到的现象是___________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_____________。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。其中氧化产物是________
(3)人体内的铁元素是以Fe2+和Fe3+的形式存在。Fe2+易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有_______(填“氧化性”或“还原性”)。
(4)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为________________________________________________
(5)写出氢气还原氧化铜反应的化学方程式,并用双线桥法表示电子转移的方向和数目。________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为![]() ,则下列说法错误的是
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列结构示意图,判断下列说法中正确的是

A. 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体
B. 在CaF2晶体中,Ca2+的配位数为4
C. 在金刚石晶体中,碳原子与碳碳键数之比为1:2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为主要原料合成一种具有果香味的物质 C 和化合物 D 的合成路线如图所示。
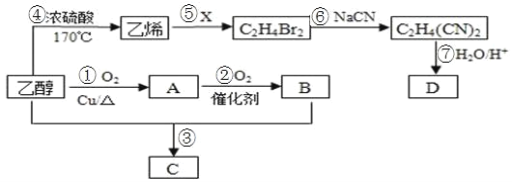
请回答下列问题:
(1)B的结构简式为_______。
(2)反应⑤的化学方程式为_______;B分子中的官能团名称为_______;反应⑥的类型为________。
(3)为了探究反应③的反应原理,通常采用“同位素示踪法”的方法,请结构简式为 CH3CH218OH,书写化反应③学方程式为_______。
(4)已知D的相对分子量为 118,其中碳、氢两元素的质量分数分别为 40.68%、5.08%,其余为氧元素,则 D 的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
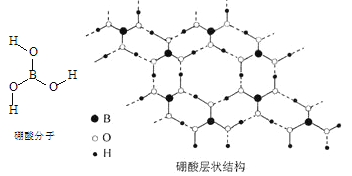
(1)B原子的结构示意图为_____________________;
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O![]() [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________;
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________;
(3)下列有关硼酸晶体的说法正确的是__________;
A.H3BO3分子的稳定性与氢键有关
B.含1 molH3BO3的晶体中有3 mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是__________。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是________;
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=_____________;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数); _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:

已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
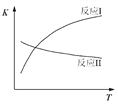
(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
① H2O的电子式是:_________________。
② 反应I的热化学方程式是:___________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
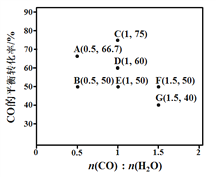
① 图中D、E两点对应的反应温度分别为TD和TE。判断:TD_______TE(填“<” “=”或“>”)。
② 经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的____相同。
③ 当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是______。
(3)反应III,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如下图所示。
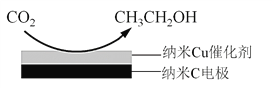
① 阴极的电极反应式是__________________________。
② 从电解后溶液中分离出乙醇的操作方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:
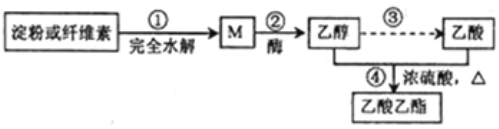
下列说法不正确的是( )
A. 加热条件下,M能与新制氢氧化铜悬浊液发生反应
B. ④的反应类型属于酯化反应,也属于取代反应
C. 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
D. 用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com