
【题目】把铁粉投入氯化亚铁和氯化铜的混合溶液中,充分反应后铁粉有剩余,则所得溶液中浓度最大的阳离子是
A.Fe2+B.Cu2+C.Fe3+D.H+
科目:高中化学 来源: 题型:
【题目】下列反应原理中,不符合工业冶炼金属实际情况的是( )
A.2Ag2O ![]() 4Ag+O2↑
4Ag+O2↑
B.2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
C.2MgO ![]() 2Mg+O2↑
2Mg+O2↑
D.4CO+Fe3O4 ![]() ?3Fe+4CO2
?3Fe+4CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是

A.A点pH小于7是因为Cu2+水解使溶液显酸性
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段阳极产物是Cl2
D.CD段电解的物质是水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图所示。
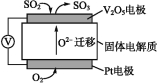
①固体电解质中O2向 (填“正”或“负”)极移动。
②写出V2O5电极的电极反应式: 。
(2)如图所示装置(Ⅰ)是一种可充电电池,装置(Ⅱ)是一种以石墨为电极的家用环保型消毒液发生器。装置(Ⅰ)中离子交换膜只允许Na+通过,充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr。
Na2S4+3NaBr。
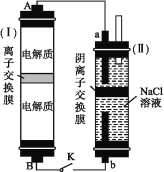
①负极区的电解质为 (用化学式表示)。
②家用环保型消毒液发生器发生反应的离子方程式为 。
③闭合开关K,当有0.04 mol Na+通过离子交换膜时,a电极上析出的气体在标准状况下的体积为
mL。
(3)下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“![]() +2I+2H+
+2I+2H+![]()
![]() +I2+H2O”设计成的原电池装置,其中C1、C2、C3、C4均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40% NaOH溶液,发现电流表指针都发生偏转。
+I2+H2O”设计成的原电池装置,其中C1、C2、C3、C4均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40% NaOH溶液,发现电流表指针都发生偏转。
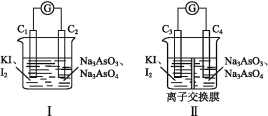
①甲组电流表指针都不发生偏转的原因是 。
②乙组添加的是 (填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙醇与浓硫酸的混合液在加热的条件下可以发生消去反应,某实验小组的同学在实验室用如下图所示装置验证消去反应的产物。(气密性已检验,部分夹持装置略)。

实验操作和选项:
操作 | 现象 |
点燃酒精灯加热至 | Ⅰ: Ⅱ: |
…… | |
实验完毕,清洗烧瓶 | Ⅲ: |
(1)烧瓶内发生的有机反应化学方程式是____________________________________,烧瓶内产生刺激性气味的气体的无机反应化学方程式是____________________________________。
(2)溶液“渐渐变黑”说明浓硫酸具有_________性。
(3)甲同学认为若![]() 中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使
中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使![]() 中溶液褪色反应的化学方程式是____________________________________。
中溶液褪色反应的化学方程式是____________________________________。
(4)乙同学却认为即使![]() 中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在
中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在![]() 、
、![]() 间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
②在![]() 、
、![]() 间增加一个盛有浓硫酸的洗气瓶,并将
间增加一个盛有浓硫酸的洗气瓶,并将![]() 中的
中的![]() 的水溶液改为
的水溶液改为![]() 的
的![]() 溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
则乙同学认为![]() 中使
中使![]() 的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使
的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使![]() 的四氯化碳溶液褪色。
的四氯化碳溶液褪色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质是
A. 胶体分散质粒子直径在1 nm~100nm之间
B. 具有丁达尔现象
C. 胶体粒子不能穿过半透膜,能通过滤纸空隙
D. 胶体粒子在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1 . B和D也属同一族,它们原子最外层的p能级电子数是同能层s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是 , B是 , E是 .
(2)写出C元素基态原子的简化电子排布式 .
(3)B、D两种元素的氢化物中,沸点大的是(写化学式),其原因是 .
(4)元素B与D的电负性的大小关系是(写元素符号,下同),C与E的第一电离能的大小关系是 . (填“>”、“<”或“=”)
(5)E位于周期表的第周期,第族;其原子结构示意图为 .
(6)A与B形成的A2B2化合物含键(填“极性键”或“非极性键”),写出该物质的电子式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com