
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1 . B和D也属同一族,它们原子最外层的p能级电子数是同能层s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是 , B是 , E是 .
(2)写出C元素基态原子的简化电子排布式 .
(3)B、D两种元素的氢化物中,沸点大的是(写化学式),其原因是 .
(4)元素B与D的电负性的大小关系是(写元素符号,下同),C与E的第一电离能的大小关系是 . (填“>”、“<”或“=”)
(5)E位于周期表的第周期,第族;其原子结构示意图为 .
(6)A与B形成的A2B2化合物含键(填“极性键”或“非极性键”),写出该物质的电子式 .
【答案】
(1)H;O;K
(2)[Ne]3s23p1
(3)H2O;水分子之间形成氢键
(4)O>S;Al>K
(5)四;IA;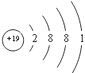
(6)极性键、非极性键;![]()
【解析】解:A、B、C、D、E5种短周期元素,它们的核电荷数依次增大,且都小于20,B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4 , 则B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1 , 处于IA族,E的原子序数大于硫,且5种元素中只有C、E是金属元素,则A为H元素、E为K元素;C原子最外层上电子数等于D原子最外层上电子数的一半,其最外层电子数为6× ![]() =3,故C为Al.
=3,故C为Al.
(1.)由上述分析可知,A为H、B为O、C为K,所以答案是:H;O;K;
(2.)C为铝元素元素,原子核外有13个电子,基态原子的简化电子排布为[Ne]3s23p1 , 所以答案是:[Ne]3s23p1;
(3.)B、D的氢化物分别为H2O、H2S,水分子之间形成氢键,而硫化氢分子之间为范德华力,故水的沸点较高,所以答案是:H2O;水分子之间形成氢键;
(4.)同主族自上而下电负性减小,故电负性O>S,金属性越强,第一电离能越小,故第一电离能Al>K,所以答案是:O>S;Al>K;
(5.)E为K元素,处于周期表中的第四周期IA族,原子结构示意图为 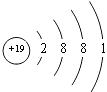 所以答案是:四、IA;
所以答案是:四、IA; 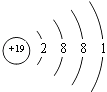 ;
;
(6.)A与B形成的H2O2化合物中氧原子之间形成非金属性、氧原子与H原子之间形成极性键,其电子式为 ![]() ,所以答案是:极性键、非极性键;
,所以答案是:极性键、非极性键; ![]() .
.


科目:高中化学 来源: 题型:
【题目】在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)![]() xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
到达平衡的时间/min | 5 | 8 | |
A的浓度/(mol·L-1) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度/(g·L-1) | ρ1 | ρ2 |
下列说法正确的是( )
A. 若x<4,则2c1<c2
B. 若w3=w1,可断定x=4
C. 无论x的值是多少,均有2ρ1=ρ2
D. 容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的FeO、Fe、Fe2O3的混合物中加入100mL 1mol/L盐酸,恰好使混合物完全溶解,放出112mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为( )
A.2.8g
B.5.6g
C.8.4g
D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施符合“绿色化学”思想的是
A. 直接排放含磷生活污水
B. 大量使用氟里昂作为冰箱制冷剂
C. 使用可降解塑料代替不可降解塑料
D. 使用化学性质稳定、不易分解的有机氯农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的___________ ,一段时间后,甲中溶液颜色 __________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明___________ ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ______________。
(3)现用丙装置给铜件镀银,则H应该是______________ (填“镀层金属”或“镀件”),电镀液是___________ 溶液(填写化学式)。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为_____________ ,甲中溶液的pH_____________(填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图,已知断裂1mol N≡N键吸收942kJ热量,生成1molN-N键释放167kJ热量根据以上信息和数据,下列热化学方程式正确的是

A. 2N2 = N4 △H = -882kJ·mol-1
B. N2 (g) = 0.5N4 (g) △H = +441kJ
C. N2 (g) = 0.5N4 (g) △H = -441kJ·mol-1
D. 2N2(g) = N4(g) △H = +882 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n)的取值范围是( )
A. n≥1 B. 1<n<2 C. 2≤n<4 D. n≥4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com