
 2CO32-+6H2O,则下列说法正确的是
2CO32-+6H2O,则下列说法正确的是| A.构成该电池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阴极 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32-+6H2O |
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
 2PbSO4+2H2O。下列说法正确的是
2PbSO4+2H2O。下列说法正确的是| A.放电时,负极的电极反应式是PbO2+4H++SO42一+2e一=PbSO4+2H2O |
| B.充电时,电解液中H2SO4的浓度将变小 |
| C.放电时,PbO2发生氧化反应 |
| D.充电时,蓄电池的正极和外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该电池负极的电极反应为:Al–3e-=Al3+ |
| B.电池工作时,溶液中铝离子向正极移动 |
| C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 |
| D.当导线中有3.612×1024个电子通过时,电池负极质量减少27 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.当电池负极消耗m g气体时,电解池阳极同时有m g气体生成 |
| B.电池的负极反应式为:O2+2H2O+4e-=4OH- |
| C.电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D.燃料电池中c(KOH)不变;电解池中溶液pH变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。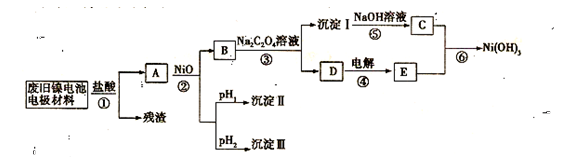
| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Pb+PbO2+2H2SO4,下列判断不正确的是( )
Pb+PbO2+2H2SO4,下列判断不正确的是( )| A.其充电过程作为电解池,放电过程作为原电池 |
| B.充电时,PbSO4在阴极转化为PbO2 |
| C.放电时,Pb作为负极 |
| D.放电时,PbO2发生还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该电池Zn为负极,MnO2为正极,电解质是KOH |
| B.放电时外电路电流由Zn流向MnO2 |
| C.电池工作时OH-向锌电极移动 |
| D.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH— |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com