
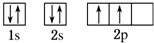
 ,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.
,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.分析 元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个电子,则A的外围电子排布为2s22p2,故A为C元素;B的3p轨道上有空轨道,则B的外围电子排布为3s23p1或3s23p2,A、B同主族,故B为Si元素;B、C同周期,C是本周期中电负性最大的,故C为Cl元素,据此答题.
解答 解:元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个电子,则A的外围电子排布为2s22p2,故A为C元素;B的3p轨道上有空轨道,则B的外围电子排布为3s23p1或3s23p2,A、B同主族,故B为Si元素;B、C同周期,C是本周期中电负性最大的,故C为Cl元素;
(1)A原子为碳,C的核外电子排布的轨道表示式 ,B原子为Si,Si的核外电子排布式为:1s22s22p63s23p2,C为Cl,Cl原子的价电子排布式为:3s23p5,
,B原子为Si,Si的核外电子排布式为:1s22s22p63s23p2,C为Cl,Cl原子的价电子排布式为:3s23p5,
故答案为: ;1s22s22p63s23p2;3s23p5;
;1s22s22p63s23p2;3s23p5;
(2)A为碳元素,B为硅元素,C为氯元素,它们气态氢化物的化学式分别是CH4、SiH4、HCl,非金属性越强,氢化物越稳定,非金属性Cl>C>Si,所以氢化物稳定性HCl>CH4>SiH4,气态氢化物最不稳定的化学式是SiH4,
故答案为:CH4、SiH4、HCl; SiH4;
(3)A、B、C形成的最高价氧化物的水化物(即最高价含氧酸)分别为:H2CO3、H2SiO3、HClO4,由于非金属性越强,其酸性越强,故酸性最强的是:HClO4,故答案为:HClO4.
点评 本题考查原子结构和元素周期律的关系,为高频考点,侧重考查学生分析判断及对元素周期律的灵活应用,明确原子结构、元素周期表结构及元素周期律是解本题关键,知道非金属性强弱与其氢化物稳定性强弱、其最高价氧化物的水化物酸性强弱关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2是氧化剂 | B. | NH3是氧化剂 | C. | O2被还原 | D. | NH3发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读分析下列材料:
阅读分析下列材料:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
| 丙三醇 C3H8O3 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是IIIA族元素 | |
| C. | 若元素Y处于第3周期,它的单质可与冷水剧烈反应 | |
| D. | 元素X与氯元素形成化合物时,化学式可能是XCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com