
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A.该溶液的pH=4
B.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
C.在该温度下加水稀释,溶液的中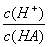 减小
减小
D.此酸的电离平衡常数约为1.0×10-7
科目:高中化学 来源:2015-2016学年吉林省高一入学摸底化学试卷(解析版) 题型:填空题
在标准状况下,有:①4.8gCH4 ②11.2LHCl ③2.408×1023个H2S气体分子 ④ 0.2molNH3
对于这四种气体而言,请用序号比较下列各项的大小。
(1)含氢原子数由多到少的顺序为_________;
(2)质量由大到小的顺序为_______________;
(3)体积由大到小的顺序为_______________;
(4)密度由大到小的顺序为_______________。
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三9月月考化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法正确的是

A.过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤
B.在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2
C.工业上通过电解饱和MgCl2溶液制取金属镁
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42—+20H+ = 4Fe3++3O2↑+10H2O
B.10mL0.5mol/L的明矾溶液与20mL0.5mol/LBa(OH)2溶液混合反应:3Ba2+ + 6OH- +2Al3+ +3SO42- = 3BaSO4↓+2Al(OH)3↓
C.铜粉与63%的硝酸反应:Cu +4H++2NO3- =Cu2++2NO2↑+ 2H2O
D.工业上用纯碱液吸收SO2:CO32-+SO2=CO2+SO32-
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次月考化学试卷(解析版) 题型:选择题
在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是
A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
C.0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上化学试卷(解析版) 题型:填空题
(12分)现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置___________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为_______ _;
该化合物和单质F反应的离子方程式为_______________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为_____ ___。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为____________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为 __。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中高二上期初考试化学试卷 (解析版) 题型:实验题
(16分)某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
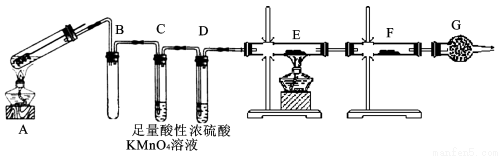
(1)填写装置的作用:B ,C ,G ,
(2)证明有SO2生成的现象是
(3)可以证明气体X中含有氢气的实验现象是:E中:_____________,F中:__________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或“不能”),原因是_________。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是 。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 ,要确认CuSO4生成,待试管冷却后, 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三9月月考化学试卷(解析版) 题型:填空题
[化学选修——5:有机化学基础](15分)立方烷(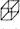 )具有高度的对称性.高致密性.高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性.高致密性.高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
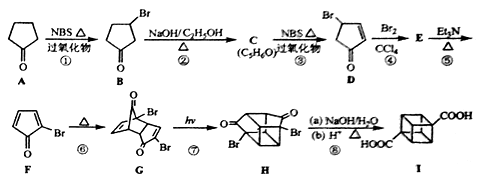
回答下列问题:
(1)C的结构简式为 ,E的结构简式为 。
(2)③的反应类型为 ,⑤的反应类型为
(3)化合物A可由环戊烷经三步反应合成:
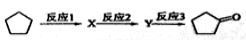
反应1的试剂与条件为 ;反应2的化学方程式为 ;反应3可用的试剂为 。
(4)在I的合成路线中,互为同分异构体的化合物是 (填化合物代号)。
(5)I与碱石灰共热可转化为立方烷。立方烷的核磁共振氢谱中有 个峰。
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有 种。
查看答案和解析>>
科目:高中化学 来源:2016届广西河池市高三上学期第一次月考理综化学试卷(解析版) 题型:填空题
(14分)亚硝酸是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化为Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白中含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。说明维生素C具有 性,亚硝酸盐具有 性(填“氧化”或“还原”)
(2)NaNO2和NaCl外观相似,肉眼不易分辨。下列方法中,不能用来区分NaNO2和NaCl的是 。
A.分别测定这两种溶液的pH值
B.酸性条件下分别将两种溶液加热
C.在酸性条件下分别加入KI-淀粉溶液
D.分别向两种溶液中滴加AgNO3溶液
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出该反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,是理想的水处理剂,其与水反应生成O2、Fe(OH)3(胶体)和KOH。
① KOH的电子式
② O2的结构式
③ K2FeO4中Fe的化合价为
④上述反应的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com