

| [O] |
| [O] |
 与HC≡CH发生类似①的反应,生成含有三个苯环的化合物Ⅵ,写出化合物Ⅵ的结构简式
与HC≡CH发生类似①的反应,生成含有三个苯环的化合物Ⅵ,写出化合物Ⅵ的结构简式 或CH2=C(CHO)2,故答案为:
或CH2=C(CHO)2,故答案为: 或CH2=C(CHO)2;
或CH2=C(CHO)2; ,该反应是取代反应,
,该反应是取代反应, ;取代反应;
;取代反应; 与HC≡CH发生类似①的反应,生成含有三个苯环的化合物的结构简式为
与HC≡CH发生类似①的反应,生成含有三个苯环的化合物的结构简式为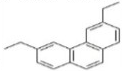 ,
, ;
;


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 实验操作 | 预期现象 | 结论 |
| Ⅰ | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,然后滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 样品含NaCl | |
| Ⅱ | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 事 实 | 结 论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | SO2通入KMnO4溶液,溶液褪色 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
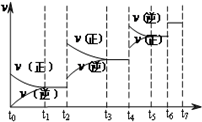 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com