
【题目】X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物 ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 ;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 、
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为 ;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。元素 E位于第四周期,与元素 Y同主族。在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
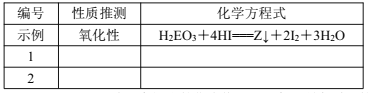
(6)由碳元素(C)、Y和 M三种元素组成的化合物 CYM中,所有原子的最外层满足 8电子结构。写出该化合物的电子式(电子式中 Y、M用元素符号表示)______________________。
【答案】(20分,除特殊标注外,余下每空2分)
(1)第二周期第ⅥA族 (2)HClO4;H2S
(3)Cl2、O3、ClO2(任写两种,其他合理答案均可)
(4)NaH+H2O===NaOH+H2↑
(5)[其中还原性,氧化性(各1分)]
1 | 还原性 | Br2+H2SeO3+H2O===H2SeO4+2HBr(或其他合理答案) |
2 | 酸性 | H2SeO3+2NaOH===Na2SeO3+2H2O (或其他合理答案) |
(6)![]()
【解析】试题分析:X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素。
(1)Y为O元素,在元素周期表中的位置为:第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4,S元素非金属性最弱,非金属气态氢化物还原性最强的是H2S,故答案为:HClO4;H2S;(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有:Cl2、O3、ClO2等,故答案为:Cl2、O3等;(4)NaH与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑,故答案为:NaH+H2O=NaOH+H2↑;(5)元素E位于第四周期,与元素Y同主族,则E为Se,H2SeO3与H2SO3相似,具有氧化性、还原性和酸性,如反应:2H2SeO3+O2═2H2SeO4(或Br2+H2SeO3+H2O═H2SeO4+2HBr)中表现还原性,反应H2SeO3+2NaOH═Na2SeO3+2H2O表现酸性。(6)由C、O和S三种元素组成的化合物COS中,所有原子的最外层都满足8电子结构,则C原子与O原子之间形成2对个共用电子对、C原子与S原子之间形成2对共用电子对,COS的电子式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】山萘酚(Kaempf erol)结构如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是 ( )

A.结构式中含有羟基、醚键、酯基、碳碳双键
B.可发生取代反应、水解反应、加成反应
C.可与NaOH反应,不能与NaHCO3反应
D.1 mol山萘酚与溴水反应最多可消耗4 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是

A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg===Mg2++2Ag+2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C. 不能被KCl溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)下列有关容量瓶的使用方法的操作中,错误的是
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中到刻度线齐平处
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀。
(2)实验室中需2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是_____________。
A.1000ml;212g B.950ml;543.4g
C.任意规格;572g D.500ml;106g
(3)现用98%、密度为1.8mol/L的浓硫酸配制500mL的稀硫酸。请回答下列问题:
①配制稀硫酸时,需要的玻璃仪器有玻璃棒、烧杯、量筒,还缺少的玻璃仪器有_________(填写仪器名称)。
②经计算,配制500mL0.2mol/L的稀硫酸需要上述浓硫酸的体积为___________。
③稀浓硫酸时,实验操作步骤:________________。
(4)误差分析:①用量筒量取浓硫酸时,仰视读数导致最终结果_____________;(填“偏大”“偏小”或“不变”)
②定容时仰视读数,导致最终结果_______________;(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH—)+c(CH3COO—)
B. 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH—)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若要使0.5mol甲烷和Cl2发生取代反应,反应后CH4与Cl2均无剩余,并生成的四种取代产物的物质的量依次增加0.05mol,则需要Cl2的物质的量为( )
A.1.75mol B.2mol C.1.25mol D.1.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com