
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 
A.加入Na2SO4可以使溶液由a点变到c点
B.通过蒸发可以使溶液由d点变到c点
C.b、d点都是不能长时间稳定存在的点
D.a点对应的Ksp大于c点对应的Ksp
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸测定NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z原子序数依次增大,其中W元素原子的最外层电子数是内层电子数的两倍。X与Z同主族,两原子的核外电子数之和为24。Y的原子半径是所有短周期主族元素中最大的。下列说法正确的是( )
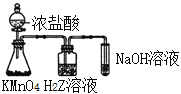
A. 简单离子半径:Z>Y>X
B. 如图所示实验可证明非金属性:Cl>Z
C. W、Y、Z的单质分别与X2反应时,X2用量不同产物均不同
D. Y分别与X、Z形成二元化合物中不可能存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000molL﹣1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 .
(2)滴定: I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号) , 该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应:判断滴定终点的现象是 .
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”、“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=;
②烧碱样品的纯度为%.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面根据海水资源综合利用,请回答下列问题:
(1)淡化海水的方法有________________(写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________(填化学式),之后________(填操作名称),再加入适量________(填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)由无水MgCl2制取金属镁的常用工业方法是__________________。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是__________。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,写出反应的离子方程式____________。再H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:
表1 浸出液成分
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
浓度/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
(1)浸出液可用有机溶剂(HR)进行萃取,实现Y3+的富集(已知:Y3+与Fe3+性质相似),原理如下:Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
浸出液在不同pH下萃取的结果如图1。
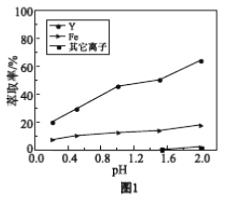
①用化学平衡原理解释,随pH增大,Y3+萃取率增大的原因________。
②结合图1解释,工业上萃取Y3+之前,应首先除去Fe3+的原因是________。
(2)采用“中和沉淀法”和“磷酸法”可以除铁。
表2 Fe3+、Y3+去除率
终点pH | 去除率/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
中和沉淀法:向浸出液中加入NaOH除Fe3+,去除率如表2所示。
①该实验条件下,Fe3+去除率比Y3+大的可能原因________。
磷酸法:将磷酸(H3PO4:三元弱酸)加入到浸出液中,再加入Na2CO3溶液,调pH为2.5,过滤除去磷酸铁沉淀(FePO4),滤液中剩余的Fe3+、Y3+浓度如表3。
表3 滤液中Fe3+、Y3+的浓度
Fe3+ | Y3+ | |
浓度/(mgL-1) | 508 | 68.9 |
② 配平“磷酸法”除铁过程中的离子方程式
Fe3+ + + = FePO4↓+ CO2↑+ ,___________________
③ 综合分析表1、表2、表3,工业上采用“磷酸法”除铁的原因________。
(3)经“磷酸法”除铁后,用有机溶剂HR萃取Y3+,可通过________(填操作)收集含Y3+的有机溶液。
(4)综合分析以上材料,下列说法合理的是________。
a. 分析图1可知,pH在0.2~2.0范围内,有机溶剂中的Fe3+多于水溶液中的Fe3+
b. 表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附
c. 表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓
d. 有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既属于氧化还原反应又属于放热反应的是( )
A.氢氧化钾与硫酸的反应
B.碳酸钙与盐酸反应放出二氧化碳
C.镁条在空气中燃烧
D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4种金属分别加入到4支装有稀盐酸的试管中,记录的现象如下表所示,正确的是
选项 | 加入的金属 | 是否有气体产生 |
A | 铜 | 有 |
B | 铁 | 有 |
C | 铝 | 无 |
D | 镁 | 无 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com