
����Ŀ������ı����Ϊ5.1��ƽ��������к�������Ϊ3.67��ƽ�����ռ��������������70.8 %��������һ����Ļ�ѧ��Դ���⣬������ݺ�ˮ��Դ�ۺ����ã���ش��������⣺
��1��������ˮ�ķ�����________________��дһ�ֺ����������ɣ����ɺ�ˮ��ȡ�Ĵ����к���Ca2����Mg2����SO42�������ӣ�Ϊ�˳�ȥ��Щ���ӣ���Ҫ���μ����Թ�����NaOH��BaCl2��________���ѧʽ����֮��________����������ƣ����ټ�������________�����Լ����ƣ�����������Һ����Ũ������ȴ�ᾧ���õ����Ρ�
��2������ˮMgCl2��ȡ����þ�ij��ù�ҵ������__________________��
��3�����±��ͨ��Cl2�û���Br2�����ÿ��������岢��SO2���գ�ת��ΪBr����������Σ��Դﵽ�������Ŀ�ġ��ɺ�ˮ��������еķ�Ӧ�ɵó�Cl����SO2��Br����ԭ����ǿ������˳����__________��
��4����ҵ��Ҳ������Na2CO3��Һ���մ�����Br2�������廯�ƺ������ƣ�ͬʱ�ų�CO2��д����Ӧ�����ӷ���ʽ____________����H2SO4����������Һ���µõ�Br2���䷴Ӧ�����ӷ���ʽΪ_______________��
���𰸡� ���� Na2CO3 ���� ���� ��ⷨ SO2��Br����Cl�� 3CO32����3Br2��5Br����BrO3����3CO2�� 5Br����BrO3����6H����3Br2��3H2O
����������1����ˮ����ˮ��Ӧ��ˮ���η��룬�����������������ӽ������ȣ��Դ˽���Ȼ�����ȥSO42-���ӣ������е�þ���ӿ��Լ���������������ȥ����Na2CO3��Һ�ȿ��Գ�ȥ��Һ�еĸ����ӻ����Գ�ȥ��Һ�ж���ı����ӣ����˺����������Գ�ȥ������̼���ƺ��������ƣ�
��2������ˮMgCl2��ȡMg���������״̬���Ȼ�þ���Եõ�þ��������
��3�����Է����е�������ԭ��Ӧ�У���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�
��4�����ݻ��ϼ�����������Ⱥ������غ���д�������廯�ƺ������ƣ�������Һ�лᷴӦ���з�Ӧ��
��1��Ŀǰ������ˮ�ķ����ж��֣��磺�����ᾧ��������Ĥ���ȣ�������õ��������Ȼ�����ȥSO42-���ӣ������е�þ���ӿ��Լ���������������ȥ����Na2CO3��Һ�ȿ��Գ�ȥ��Һ�еĸ����ӻ����Գ�ȥ��Һ�ж���ı����ӣ���Ҫ���μ����Թ�����NaOH��BaCl2��Na2CO3�����˺�����Һ�м����������������������ɣ���������Һ����Ũ������ȴ�ᾧ���õ����Σ�
��2������þ���ڻ��ý�������ˮ�Ȼ�þ������״̬�£�ͨ�����MgCl2![]() Mg+Cl2���õ�����þ��
Mg+Cl2���õ�����þ��
��3�����Է����е�������ԭ��Ӧ�У���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�Cl2+2Br-=Br2+2Cl-�л�ԭ��ΪBr-��Cl-��SO2+2H2O+Br2=H2SO4+2HBr�л�ԭ��ΪSO2��Br-�����Ի�ԭ��ǿ��˳����SO2��Br-��Cl-��
��4����ҵ��Ҳ������Na2CO3��Һ���մ�����Br2�����������廯�ƺ������Ƽ���ɫ���������̼�ų������ӷ�Ӧ����ʽΪ3CO32����3Br2��5Br����BrO3����3CO2���������廯�ƺ������ƣ��������H2SO4�����õ�Br2�������Ӻ����������������Һ�з���������ԭ��Ӧ�����嵥�ʣ���Ӧ�����ӷ���ʽΪ5Br����BrO3����6H����3Br2��3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ƚ��У���ȷ��
A.ԭ�Ӱ뾶��Al��Mg��NaB.�ȶ��ԣ�HF��H2O��NH3
C.���ԣ�H2CO3��H2SO4��HClO4D.���ԣ�Al(OH)3��Mg(OH)2��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A���������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������ʵ�������ʾ��
ʵ�鲽�� | ���ͻ�ʵ����� |
��ȡA9.0g������ʹ��仯�������ܶ�����ͬ������H2��45�� | ��A����Է�������Ϊ |
����9.0gA��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g | ��A�ķ���ʽΪ |
��ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2����״�������������������Ʒ�Ӧ������2.24LH2����״���� | ���ýṹ��ʽ��ʾA�к��еĹ����� |
A�ĺ˴Ź���������ͼ�� | ������������A�Ľṹ��ʽΪ |
����֪������A��һ�������¿�������Ԫ��״����д���÷�Ӧ�Ļ�ѧ����ʽ�� �� | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������:
��1���������������������ʴ��ÿ����ʴ����ʧ�ĸ���ռ���������������ķ�֮һ�� 
�ٸ�����ʴ��Ҫ��������ʴ���ø�ʴ�����е�������ӦʽΪ ��
��Ϊ�˽���ijˮ�����բ�ű���ʴ�����ʣ����Բ�����ͼ����ʾ�ķ��������к�������բ���ϵĹ������ R ���Բ��� ��
A��ͭB����C��пD��ʯī
����ͼ�ҷ���Ҳ���Խ�����բ�ŵĸ�ʴ���ʣ�������բ��Ӧ��������ֱ����Դ�����ϣ�
��2�����ݷ�Ӧ Fe+Fe2��SO4��3�T3FeSO4��Ƶ�˫Һԭ�����ͼ����ʾ��
�ٵ缫��IJ���Ϊ�����������ձ� A �еĵ������ҺΪ���ѧʽ��
�ڵ缫�����ĵ缫��ӦʽΪ ��
��3��ijͬѧ��װ����ͼ����ʾ�ĵ绯ѧװ�ã��缫��Ϊ Al�������缫��Ϊ Cu�� �ٵ缫��Ϊ�������������������������������������Ӧ����������� ԭ�������缫��ӦʽΪ���缫��Ϊ�������������������������������
��������ʢ�к� KNO3 ��Һ����֬�������е� K+����������ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ������� 
A.����Na2SO4����ʹ��Һ��a��䵽c��
B.ͨ����������ʹ��Һ��d��䵽c��
C.b��d�㶼�Dz��ܳ�ʱ���ȶ����ڵĵ�
D.a���Ӧ��Ksp����c���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����ɫ���š�����ת��������ɳ�����չ����Ҫս��֮һ��
��1��CO2��Դ֮һ������β��
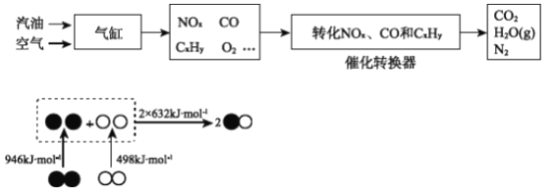

�ٸ�����ͼ��д�������ڲ���NO���Ȼ�ѧ����ʽ________��
��д��ת�������ڴ���������NOx��CO��Ӧ�Ļ�ѧ����ʽ________��
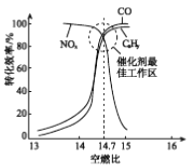
���ڴ�ת�����л�����β��ת��Ч�����ȼ�ȣ�������ȼ����������ȣ��Ĺ�ϵ����ͼ������ȼ��С��14.7���������㣬CxHy��CO���ܱ���ȫ������������ת��Ч�ʽ��ͣ�����ȼ�ȴ���14.7����NOx��ת��Ч�ʽ��ͣ�ԭ����________��
��2������NaOH��Һ���������� CO2
��֪��0.448L CO2���������״������NaOH��Һ������գ��õ�100mL����Na2CO3��NaHCO3������Һ��
��������Һ�м�������BaCl2��Һ�õ������������ˡ�ϴ�ӡ��������Ϊ1.97g��������Һ��c(Na2CO3) = ________������������NaHCO3��BaCl2����Ӧ��
�ڶԸ�����Һ�������ж���ȷ����________��
a . c (CO32- ) > c (HCO3- )
b. 2c (CO32- ) + c (HCO3- ) + c (OH- ) = c (H+ ) + c (Na+ )
c. c (H2CO3) + c (HCO3- ) + c (CO32- ) =0.2molL-1
��3����ҵ�Ͽ���CO2���Ƽ״�
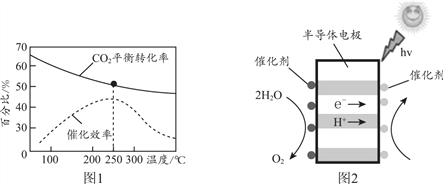
��CO2 (g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ��H < 0
CH3OH(g) + H2O(g) ��H < 0
����ͼ1������ʵ�ʹ�ҵ�����У���Ӧ�¶�ѡ��250��������________��
�����ù���ԭ������CO2��H2O�Ʊ�CH3OH��װ����ͼ2��д���Ҳ�ĵ缫��Ӧʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a.ij�л���A��ѧʽΪCxHyOz��15 gA��ȫȼ������22 gCO2��9 gH2O����ȷ����
��1�����л�������ʽ______________��
��2����A����Է�������Ϊ60�Һ�Na2CO3���������ų���A�ʹ��ܷ���������Ӧ����A�Ľṹ��ʽΪ _______________ ��
��3����A����Է�������Ϊ60�����ӷ���ˮ����ζ��Һ�壬�ܷ���ˮ�ⷴӦ������ṹ��ʽΪ______________��
��4����A���ӽṹ�к���6��̼ԭ�ӣ����ж�Ԫ����ȩ�����ʣ�����ṹ��ʽΪ_______��
b.�л���A��B��C��D��һ������������ͼ��ʾ��ת����ϵ��

��ش������й����⣺
��1��д��B�ķ���ʽ��____________________��
��2���ֱ�д����Ӧ���ķ�Ӧ����ʽ______________�����ķ�Ӧ����ʽ________________________
��3�����ķ�Ӧ����Ϊ___________________________��
��4��������D��Ũ������ڵ������¼��ȿ��Է���������������Ӧ����E��F����E����Է���������F��С����E��F�Ľṹ��ʽ�ֱ�Ϊ___________________��_________________��
��5�����й����л���A��˵����ȷ����__________________(�����)��
a���������������ӣ����м���
b���ܷ����Ӿ۷�Ӧ
c����ʹ��ˮ��ɫ
d����һ����������������ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1032molL��1 HCl��Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ��
��1��ijͬѧ�����в������ʵ�飺��ȡһ��ƿ���ô���NaOH��Һ��ϴ���Σ� ������ƿ�м��� 25��.00 mL����NaOH��Һ���ۼ��뼸��ʯ���Լ���ָʾ������ȡһ֧��ʽ�ζ��ܣ�ϴ�Ӹɾ��� ��ֱ������ʽ�ζ�����ע�������Һ�����еζ��� ������ע���ŵζ�����������ҺҺ���½���ֱ���ζ��յ㣮
�������������д�������Ϊ
��2��ȡ��25.00 mL����NaOH��ҺӦ��������ѡ����ס������ҡ���װ�ã���ȡ��NaOH��Һ��ʼƽ�Ӷ���������ʱ���Ӷ������ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰�� ![]()
��3�����ζ���ʼǰ�ζ��ܼ�������һ���ݣ��ζ�������������ʧ�� ��ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰��
��4����ƽ��ʵ�����Σ���¼���������±�
�ζ����� | ������Һ�������/mL�� | ��HCl��Һ����� | |
�ζ�ǰ������/mL�� | �ζ��������/mL�� | ||
�� | 25.00 | 1.02 | 21.04 |
�� | 25.00 | 2.00 | 22.98 |
�� | 25.00 | 0.20 | 20.18 |
�Լ������NaOH��Һ�����ʵ���Ũ�ȣ��г�������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�b�缫�ý���M�Ƴɣ�a��c��dΪʯī�缫����ͨ��Դ������M������b����ͬʱa��d�缫�ϲ������ݣ��Իش� 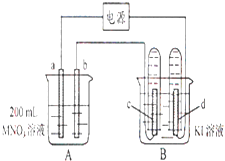
��1��aΪ����d���ĵ缫��ӦʽΪ�� ��
��2����ʼʱ����B�ձ�������μ��ε�����Һ�����ܹ۲쵽�������� �� ������һ��ʱ�������c���ϵ��Թ���Ҳ�ռ��������壬��ʱc���ϵĵ缫��ӦΪ�� ��
��3����d�缫���ռ���44.8ml���壨��״����ʱֹͣ��⣬��b�缫�ϳ�������M������Ϊ0.432g����˽�����Ħ������Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com