
����Ŀ����0.1032molL��1 HCl��Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ��
��1��ijͬѧ�����в������ʵ�飺��ȡһ��ƿ���ô���NaOH��Һ��ϴ���Σ� ������ƿ�м��� 25��.00 mL����NaOH��Һ���ۼ��뼸��ʯ���Լ���ָʾ������ȡһ֧��ʽ�ζ��ܣ�ϴ�Ӹɾ��� ��ֱ������ʽ�ζ�����ע�������Һ�����еζ��� ������ע���ŵζ�����������ҺҺ���½���ֱ���ζ��յ㣮
�������������д�������Ϊ
��2��ȡ��25.00 mL����NaOH��ҺӦ��������ѡ����ס������ҡ���װ�ã���ȡ��NaOH��Һ��ʼƽ�Ӷ���������ʱ���Ӷ������ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰�� ![]()
��3�����ζ���ʼǰ�ζ��ܼ�������һ���ݣ��ζ�������������ʧ�� ��ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰��
��4����ƽ��ʵ�����Σ���¼���������±�
�ζ����� | ������Һ�������/mL�� | ��HCl��Һ����� | |
�ζ�ǰ������/mL�� | �ζ��������/mL�� | ||
�� | 25.00 | 1.02 | 21.04 |
�� | 25.00 | 2.00 | 22.98 |
�� | 25.00 | 0.20 | 20.18 |
�Լ������NaOH��Һ�����ʵ���Ũ�ȣ��г�������̣���
���𰸡�
��1���٢ۢݢ�
��2���ң�ƫ��
��3��ƫ��
��4��c��NaOH��= ![]() =0.08256mol/L��
=0.08256mol/L��
���������⣺��1������ƿװ����Һʱ������ϴ�����Բ����ô���NaOH��Һ����ƿ���ʢٴ���
����ƿ����ʢװһ������Ĵ���Һ���ʢ���ȷ��
����ʯ����ָʾ������ɫ�����ԣ��ʢ۴���
��ȡһ֧��ʽ�ζ��ܣ�ϴ�Ӹɾ����ʢ���ȷ��
����ʽ�ζ���Ҫ�ñ�����Һ��ϴ���Σ�����ֱ������ʽ�ζ�����ע�������Һ�����еζ����ʢݴ���
������Ӧ��ע������ƿ����Һ��ɫ�仯���ʢ���
���Դ�����Т٢ۢݢޣ�
���Դ��ǣ��٢ۢݢޣ���2��������Һʢ���ڼ�ʽ�ζ����У�ͼ�м�Ϊ��ʽ�ζ��ܣ���Ϊ��ʽ�ζ��ܣ�����ʢ�������У�ȡ��NaOH��Һ��ʼƽ�Ӷ���������ʱ���Ӷ����������ƫ�ζ�ʱ���ĵı���Һ�����ƫ��������������������ҺŨ��ƫ��
���Դ��ǣ��ң�ƫ��3�����ζ���ʼǰ�ζ��ܼ�������һ���ݣ��ζ�������������ʧ�������ĵı���Һ�����ƫ����c�����⣩= ![]() ��֪����������������ҺŨ��ƫ��
��֪����������������ҺŨ��ƫ��
���Դ��ǣ�ƫ��4�����εζ���������ֱ�Ϊ20.02mL��20.98mL��19.98mL�����еڶ������ϴ�ȡ��һ���������ƽ��ֵΪ20.00mL��c��NaOH��= ![]() =0.08256mol/L��
=0.08256mol/L��
��NaOH��Һ�����ʵ���Ũ��Ϊ0.08256mol/L��
�����㾫����������Ĺؼ�������������к͵ζ������֪ʶ�������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����Ϊ�˼��ٸֹ�����ʴ��ɵ���ʧ��������ͼ���������������������еĸֹܡ������й�˵����ȷ���ǣ� ��

A. �ڳ�ʪ�����������иֹ���Ҫ������ѧ��ʴ
B. �ڳ�ʪ�����������н�����M������ͨ����������ֹ�
C. �ڳ�ʪ������������H+�������M �ƶ�������H+�����ķ�Ӧ
D. �ֹ��������MҲ���õ��߷ֱ�����ֱ����Դ����������ʹ�ֹܱ���ĸ�ʴ�����ӽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ı����Ϊ5.1��ƽ��������к�������Ϊ3.67��ƽ�����ռ��������������70.8 %��������һ����Ļ�ѧ��Դ���⣬������ݺ�ˮ��Դ�ۺ����ã���ش��������⣺
��1��������ˮ�ķ�����________________��дһ�ֺ����������ɣ����ɺ�ˮ��ȡ�Ĵ����к���Ca2����Mg2����SO42�������ӣ�Ϊ�˳�ȥ��Щ���ӣ���Ҫ���μ����Թ�����NaOH��BaCl2��________���ѧʽ����֮��________����������ƣ����ټ�������________�����Լ����ƣ�����������Һ����Ũ������ȴ�ᾧ���õ����Ρ�
��2������ˮMgCl2��ȡ����þ�ij��ù�ҵ������__________________��
��3�����±��ͨ��Cl2�û���Br2�����ÿ��������岢��SO2���գ�ת��ΪBr����������Σ��Դﵽ�������Ŀ�ġ��ɺ�ˮ��������еķ�Ӧ�ɵó�Cl����SO2��Br����ԭ����ǿ������˳����__________��
��4����ҵ��Ҳ������Na2CO3��Һ���մ�����Br2�������廯�ƺ������ƣ�ͬʱ�ų�CO2��д����Ӧ�����ӷ���ʽ____________����H2SO4����������Һ���µõ�Br2���䷴Ӧ�����ӷ���ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������£���100mL����������NaOH��Һʱ����Һ��pH�仯ͼ����ͼ�����ý�����ȷ���ǣ������� 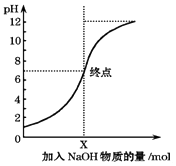
A.ԭ����������ʵ���Ũ��Ϊ0.1mol/L
B.NaOH��Һ��Ũ��Ϊ0.1mol/L
C.pH=1��pH=7�ĵ��Ӧ��Һ��ˮ�ĵ���̶���ͬ
D.X��NaOH��Һ�����Ϊ100mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�м�����������ԭ��Ӧ�����ڷ��ȷ�Ӧ���ǣ� ��
A.��������������ķ�Ӧ
B.̼��������ᷴӦ�ų�������̼
C.þ���ڿ�����ȼ��
D.Ba(OH)2��8H2O��NH4Cl��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ���H2O2��ȡO2������˵������ȷ���ǣ� ��
A.H2O2�����к��м��Լ��ͷǼ��Լ�
B.H2O������ֻ�����Լ�
C.H2O2����������ԭ�Ӷ��ﵽ8�����ȶ��ṹ
D.�÷�Ӧ��H2O2��������Ҳ�ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ̬����Li-Sb��ؾ��������Ķ����������ԣ�����ԭ����ͼ��ʾ���õ�ص����������Һ���ֳ�3��(����Li��Sb�ɻ���)������˵����ȷ����
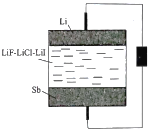
A. ��طŵ�ʱLiΪ����
B. ��Li����Na����߸õ�صı�����
C. �õ�س��ʱ��������������������
D. ��Sb�缫�г�����Pb��Ŀ���ǽ��õ�ع����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����̰��������װ�(OMS-2)��һ�����͵Ļ��������������̿�ͻ�������Ҫ�ɷֱַ�ΪMnO2��FeS2���ϳ�OMS-2�Ĺ����������£�
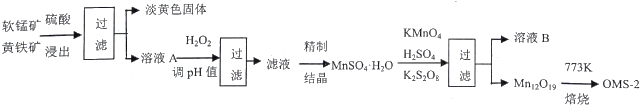
��1��FeS2����Ԫ�صĻ��ϼ���_________������pH�����ˡ���Ҫ��ȥ______Ԫ�ء�
��2��Mn12O19����Ԫ�ػ��ϼ۾�Ϊ-2�ۣ���Ԫ�صĻ��ϼ������֣���Mn (��)��Mn (��) ���ʵ���֮��Ϊ_______________�����������е�ԭ��KMnO4��K2S2O8��MnSO4��H2O�����ʵ�����1:1:5��Ӧ����������Ԫ��ȫ����SO42-����ʽ���ڣ��÷�Ӧ�����ӷ���ʽΪ__________________________��
��3����ҺB�ɽ�һ�������������Ҫ�����һ�ֿ��ڸù�����ѭ��ʹ�ã���ѧʽ��____________����һ��Ϊ���࣬��ũҵ�����п�����___________________________��
��4��OMS-2��һ�������ķ���ɸ���ֱ���OMS-2��MnOx�Լ�ȩ���д�����������ͬʱ���ڼ�ȩת���ʺ��¶ȵĹ�ϵ��ͼ��
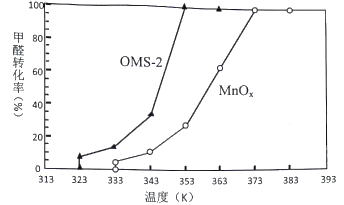
��ͼ��֪��OMS-2��MnOx��ȣ���Ч�ʽϸ���____________________��ԭ����________________��
��5����ȩ(HCHO)��OMS-2����������������CO2��H2O��������OMS-2��ij�ܱտռ�ļ�ȩ���д�����ʵ�飬ʵ�鿪ʼʱ���ÿռ��ڼ�ȩ����Ϊ1.22mg/L��CO2����Ϊ0.590mg/L��һ��ʱ�����CO2����������1.25mg/L����ʵ���м�ȩ��ת����Ϊ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaCO3��Ħ������Ϊ100gmol ��1����5.0gCaCO3������ȫ����ϡ�������������ˮϡ�ͳ�100ml��Һ������Һ��Ca2+�����ʵ���Ũ��Ϊ
A��5.0 molL��1 B��0.10 molL��1 C��1.0 molL��1 D��0.50 molL��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com