
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
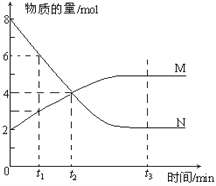
(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
【答案】 2N![]() M (或M
M (或M![]() 2 N) t3 = 2﹕1 能 AD
2 N) t3 = 2﹕1 能 AD
【解析】(1)M物质的量增大、N的物质的量减小,故N为反应物、M为生成物,最终N的物质的量不变且不为0,则该反应属于可逆反应,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,则N、M的化学计量数之比为2:1,故反应方程式为:2NM;
(2)在t3时刻M、N的物质的量为定值,处于平衡状态,故在t3时刻v正=v逆,达到平衡状态后,平均反应速率v(N)﹕v(M)=2:1;
(3)反应方程式为:2NM,反应前后气体物质的量不相等,恒温恒容下,随反应想容器内压强发生变化,压强不变说明反应到达平衡;
(4)A.升高温度,反应速率加快,故A正确;B.降低压强,反应速率减慢,故B错误;C.减小M的浓度,反应速率减慢,故C错误;D.将反应容器体积缩小,压强增大,浓度增大,反应速率加快,故D正确,故选AD。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】(1)已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为____________________;
(2) 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。

写出该电池负极的电极反应式___________________________________;
当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少____________mol离子
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,其电极反应式为______________________________;
(4)标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液相关问题
(1)下列事实可证明氨水是弱碱的是_______(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0.1 mol· L-1氯化铵溶液的pH 为5
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于7,则溶液中c(H2CO3)_______c(CO32-)(填“>”、 “=”或“<”),原因是________(文字说明);常温下,已知0.1 mol·L-1NaHCO3溶液的pH等于8,则溶液中c(H2CO3)-c(CO32-)=_____________mol··L-1(写出计算数值结果)。
(3)现有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是_____________。
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1 mol·· L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
(4)用标准浓度的酸性KMnO4溶液滴定草酸(H2C2O4)溶液的测定其物质的量浓度。
① 滴定时,KMnO4溶液应装在__________(填“酸式”、“碱式”)滴定管中。
②滴定达到终点的标准是:__________________。
③滴定时所发生反应的离子方程式:_____________________。
④实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是___________。
A.称取草酸晶体(7.2g)时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认识有机物相关问题
(1)有机物 的系统命名为________________。
的系统命名为________________。
(2)有机物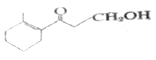 的分子式为_____________。所含的含氧官能团的名称为___________。
的分子式为_____________。所含的含氧官能团的名称为___________。
(3)根据题意,将下列正确的组号填写在空格上
①金刚石与“足球烯”;②氧气(O2)与臭氧(O2)
③16O、17O、18O;④CH4和CH3CH3CH3;
⑤乙烯和乙烷⑥![]() 和
和![]() ⑦
⑦![]() 和
和
⑧D和T⑨ 和
和 ⑩
⑩ 和
和
是同分异构体的是__________________。
(4)有机物A的分子式为C6H12O,其核磁共振氢谱如图A所示。有机物B的分子式为C2H6Br3,核磁共振氢谱如图B所示


A的结构简式为:_____________,B的结构简式为:____________________;
(5)分子式C6H12的化合物有多种同分异构体,其中有一种同分异构体中所有碳原子都在同一平面上,则该烃的结构简式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巧妙的实验设计冇助于更好地解决问题,下列装置不能达到实验目的的是

A. 用装置甲验证HCl气体易溶于水
B. 用装置乙可以验证SO2具有漂白性
C. 用装置丙检验NH4Cl分解产生的气体
D. 用装置丁采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氧元素及其化合物与人类的生产、生活密切相关。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),己知部分化学键的键能:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/KJmol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为_____________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(3)在三个容积均为1L的密闭容器中以不同的氢碳比![]() 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
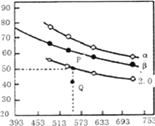
请回答下列问题:
①反应的△H______0,氢碳比α____β,Q点v(正)_____v(逆)(填“>”或“<”、“=”)
②若起始时,CO2的浓度分别为0.5mol/L,則P点对应温度度的平衡常数的值为________。
(4)己知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
① 下列微粒可以大量共存的是_______(填字母)。
a.CO32-、HC2O4- b.H2CO3、C2O42- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物在生产生活中有重要的用途。
(1)溴原子的核外电子排布式为[Ar]__________,有_____个未成对电子。
(2)在一定浓度的 HF 溶液中,氟化氢是以缔合形式(HF)2 存在的。使氟化氢分子缔合的作用力是____________。
(3)根据下表数据,分析熔点和硬度变化的原因:________________。

(4)HIO3 的酸性_____(填“强于”或“弱于”)HIO4,原因是_________________。
(5)ClO2中心氯原子的杂化类型为________,ClO3的空间构型为__________。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是 CaF2 的晶胞,其中原子坐标参数 A 处为(0,0,0);B 处为(![]() ,
, ![]() ,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为__________。
,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为__________。

②晶胞参数:描述晶胞的大小和形状。已知 CaF2 晶体的密度为 c gcm3,则晶胞中 Ca2+与离它最近的 F之间的距离为_________ nm(设 NA 为阿伏加德罗常数的值,用含 c、NA 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)【[化学—有机化学基础】没食子酸丙酯简称PG,结构简式为 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
(1)PG的分子式为 ,请写出PG分子中所含官能团的名称 ,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是 。
PG可发生如下转化:
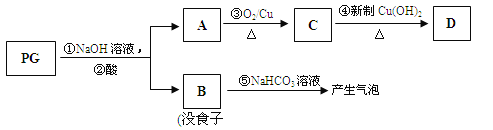
(2)A的结构简式为 ,1mol没食子酸最多可与 mol H2 加成。
(3)上图的有关变化中,属于氧化反应的有(填序号) 。
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号) 。
a.含有苯环 b.含有羧基 c.含有酚羟基 d.微溶于食用油
(5)反应④的化学方程式为: 。
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式: 。
i.含有苯环,且苯环上的一溴代物只有一种;
ii.既能发生银镜反应,又能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com