
【题目】(1)已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为____________________;
(2) 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。

写出该电池负极的电极反应式___________________________________;
当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少____________mol离子
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,其电极反应式为______________________________;
(4)标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为_____________。
【答案】 436 kJ Ag- e-+Cl-=AgCl 0.02 mol Al- 3e-+4OH-=AlO2-+2H2O 3:1
【解析】(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则根据1g氢气即0.5mol氢气完全燃烧生成水蒸气时放出热量121kJ可知2×2×463kJ-496kJ-2×x=4×121kJ,解得x=436 kJ,即氢气中1molH-H键断裂时吸收热量为436 kJ;(2)根据电池总反应为2Ag+Cl2=2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,该电池负极的电极反应式为 Ag-e-+Cl-=AgCl;放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中共约减少0.02mol离子;(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,失去电子转化为偏铝酸根离子,其电极反应式为Al-3e-+4OH-=AlO2-+2H2O;(4)标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,物质的量为3.125mol;设丙烷物质的量为X,丁烷物质的量为1-X,则根据反应的方程式可知
C3H8(g)+5O2(g)→3CO2(g)+4H2O(l)△n
1 3
X 3X
2C4H10(g)+13O2(g)→8CO2(g)+10H2O(l)△n
2 7
1-X 3.5(1-X)
3X+3.5(1-X)=3.125
解得X=0.75mol
所以混合气体中丙烷和丁烷的体积比=0.75:(1-0,75)=3:1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池示意图,下列关于锌铜原电池的说法正确的是( )

A. 负极发生的反应是:2H+ +2e—=H2↑
B. 溶液中SO42-向铜片的方向移动
C. 该装置实现了化学能转化为电能
D. 若生成0.2mol H2,则有6.5克锌被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是

A. XZ线上任意点均呈中性,pH=7
B. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
C. M区域内任意点均有c(H+)<c(OH-)
D. 图中T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法中正确的是( )
A. 电极一定要由两种不同的金属组成
B. 电子流出的一极是正极
C. 两极均发生氧化还原反应
D. 由化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是( )
A.摩尔是国际单位制的一个基本物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.表示6.02×1023个粒子的集合体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将1mol H2和11.2 L O2混合,得到气体的体积为( )
A.12.2 L B.<22.4 L C.33.6 L D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检测某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组设计了如下实验流程:

(1)通入N2的目的是_______________________
(2)第①步反应的离子方程式是______________________
(3)滴定实验若选择酚酞作指示剂,则滴定终点的标志是________滴定过程中以下操作使测定结果偏高的是________(填编号)
a. 洗净的滴定管未用标准液润洗
b. 滴定中向锥形瓶内壁加少量水
c. 滴定前滴定管正常,滴定后尖嘴部分有气泡
d. 锥形瓶用待测液洗涤2-3次
(4)若实验室欲制取SO2可选用试剂__________(填编号)
a. 铜和浓硫酸 b. 硫和氧气
c. 亚硫酸钠和浓度70%的硫酸 d. 亚硫酸钙和硝酸
(5)往BaCl2溶液中通入SO2至饱和,无明显现象,再通入NH3后出现白色沉淀,此时溶液中一定有的溶质是_________。请用电离平衡解释上述实验现象:_________________
(6)H2O2是一种绿色氧化剂。某NH4Cl样品中含少量Fe2+、SO42-,将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,即得到工业氯化铵。
滤渣的主要成分是_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
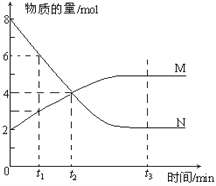
(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com