
【题目】如图为铜锌原电池示意图,下列关于锌铜原电池的说法正确的是( )

A. 负极发生的反应是:2H+ +2e—=H2↑
B. 溶液中SO42-向铜片的方向移动
C. 该装置实现了化学能转化为电能
D. 若生成0.2mol H2,则有6.5克锌被还原
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
四 | ⑩ |
(1)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号);
(2)⑦的氢氧化物与⑥的最高价氧化物的水化物反应的化学方程式:
_____________________________________________________。
(3)⑧⑨两种元素形成的化合物的最高价含氧酸的酸性强弱顺序是⑧_____⑨。
(4)①③两种元素形成的化合物的水溶液显_____(填“酸”、“中”或“碱”)性。
(5)④⑧两种元素所形成的气态氢化物中较不稳定的是___________(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
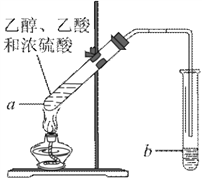
(1)乙酸分子中-COOH原子团的名称是_______。
(2)装置b中通蒸气的导管应置于饱和碳酸钠溶液的液面上而不能插入溶液中,目的是_________________。
(3)浓硫酸的作用是____________、____________。
(4)试管 a 中发生反应的化学方程式为_________________,反应类型是____________。
(5)反应时生成的乙酸乙酯密度比水________,可以闻到_______味。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.
(1)B的气态氢化物的电子式为_____________,请用电子式表示A与C形成化合物的过程____________。
(2)E在周期表中的位置为______________________。
(3)下列说法正确的有_________。
①化合物乙分子中只含有极性共价键
②化合物甲和化合物丙都含有离子键和共价键
③B、E分别与A形成的简单化合物中,B的更稳定
④C、D、E、F原子半径由大到小的顺序为C>D>E>F
(4)写出由以上元素构成的10电子分子与18电子分子按物质的量之比1:1反应生成盐的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
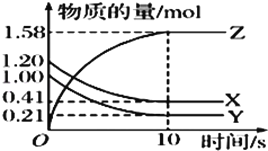
(1)该反应的化学方程式为_____。
(2)从反应开始到10s时,用Y表示的反应速率为________,X的转化率为_____。(均保留三位有效数字)
(3)10s时,该反应___达到了化学平衡状态。(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为136的芳香族化合物和相对分子质量为74的饱和一元醇发生酯化反应,生成酯的结构可能有(不考虑立体异构)
A. 8种 B. 12种 C. 16种 D. 32种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是一种具有香蕉气味的香精,实验室制备乙酸异戊酯的反应原理、装置示意图和有关数据如下:
【实验原理】

【装置与数据】


【查阅资料】分水器能将反应产生的水从反应体系中分离开来。乙酸乙酯可与无水CaCl2反应。
【实验步骤】
①酯化:在干燥的A中加入6.6异戊醇、9.0g冰醋酸、1.0mL浓硫酸,混匀后放入1~2粒沸石。按图组装好反应装置。检查装置气密性后,缓缓加热A,大约需要1h反应基本完成。
②洗涤:停止加热,冷却后将A中的反应液倒入分液漏斗中,用15mL冷水淋洗烧瓶内壁,洗涤液并入分液漏斗。充分振摇,接通大气静置,分层后分去水层。再用15mL冷水重复操作一次。然后酯层用20mL 5%碳酸氢钠溶液分两次洗涤。最后再用15mL饱和食盐水洗涤一次。
③干燥:将洗涤后的酯层倒入干燥的锥形瓶中,加入2g无水硫酸镁,配上塞子,充分振摇后,放置30min。
④蒸馏:将干燥好的粗酯蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯5.2 g。
回答下列问题:
(1)仪器A的名称为 。球形冷凝管中冷凝水的进口是 (填“a”或“b”)。
(2)从化学平衡的角度分析分水器的作用是 。
(3)分液操作中,充分振荡静置分层后,酯层分离出来的方法是 。
(4)酯层用20mL 5%碳酸氢钠溶液洗涤的现象是 。
(5)干燥时加入的无水硫酸镁不能换成无水CaCl2,理由是 。
(6)本实验的产率为 。
(7)本实验中加入过量乙酸能提高醇的转化率,为何不加入过量的醇从而提高乙酸的转化率?其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒定的容器中充入2molA和1molB发生反应:2A(g)+ B(g)![]() xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
A. 只能为2 B. 只能为3
C. 可能是2,也可能是3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为____________________;
(2) 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。

写出该电池负极的电极反应式___________________________________;
当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少____________mol离子
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做负极,其电极反应式为______________________________;
(4)标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com