
����Ŀ��������������һ�־����㽶��ζ���㾫��ʵ�����Ʊ������������ķ�Ӧԭ����װ��ʾ��ͼ���й��������£�
��ʵ��ԭ����

��װ�������ݡ�


���������ϡ���ˮ���ܽ���Ӧ������ˮ�ӷ�Ӧ��ϵ�з��뿪������������������ˮCaCl2��Ӧ��
��ʵ�鲽����
���������ڸ����A�м���6.6���촼��9.0g�����ᡢ1.0mLŨ���ᣬ���Ⱥ����1��2����ʯ����ͼ��װ�÷�Ӧװ�á����װ�������Ժ�������A����Լ��Ҫ1h��Ӧ������ɡ�
��ϴ�ӣ�ֹͣ���ȣ���ȴ��A�еķ�ӦҺ�����Һ©���У���15mL��ˮ��ϴ��ƿ�ڱڣ�ϴ��Һ�����Һ©���������ҡ����ͨ�������ã��ֲ���ȥˮ�㡣����15mL��ˮ�ظ�����һ�Ρ�Ȼ��������20mL 5��̼��������Һ������ϴ�ӡ��������15mL����ʳ��ˮϴ��һ�Ρ�
�������ϴ�Ӻ�����㵹��������ƿ�У�����2g��ˮ����þ���������ӣ������ҡ����30min��
����������õĴ����������ռ�140��143 ����֣�������������5.2 g��
�ش��������⣺
��1������A������Ϊ ������������������ˮ�Ľ����� ���a����b������
��2���ӻ�ѧƽ��ĽǶȷ�����ˮ���������� ��
��3����Һ�����У�������÷ֲ�������������ķ����� ��
��4��������20mL 5��̼��������Һϴ�ӵ������� ��
��5������ʱ�������ˮ����þ���ܻ�����ˮCaCl2�������� ��
��6����ʵ��IJ���Ϊ ��
��7����ʵ���м��������������ߴ���ת���ʣ�Ϊ�β���������Ĵ��Ӷ���������ת���ʣ���ԭ���� ��
���𰸡�
��1��������ƿ��1�֣� b��1�֣�
��2��������Ӧ�ǿ���ģ���ȥ��Ӧ�����ɵ�ˮ��ʹ��Ӧ����������Ӧ������У��Ӷ�������IJ���
��2�֣�
��3���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����رջ������ٽ��������������Ͽڷų���2�֣�
��4�����ִ���С���ݣ�2�֣�
��5����ˮCaCl2����������������Ӧ��Ӱ����ʣ�2�֣�
��6��53.3%��2�֣�
��7����Ϊ�������С�մ�Ӧ�������ӻ���������ɣ����������Ч���������������촼�������Ϊ������Ч�����Ǻܺã�2�֣�
��������
���������
��1����װ��ʾ��ͼ��֪װ��A��������������ƿ������������������ˮ�����½��ϳ��ķ�ʽ��������ˮ�Ľ�����b��
��2��������Ӧ�ǿ���ģ���ʵ���ȡ������������ᣬ����ȥ��Ӧ�����ɵ�ˮ��ʹ��Ӧ����������Ӧ������У��Ӷ�������IJ��ʡ�
��3�����������ܶȱ�ˮС�����������ܣ����ˮ���²㣬�����ϲ㡣��Һʱ��Ҫ�Ƚ�ˮ��ӷ�Һ©�����¿ڷų�����������Һ�����ʱ�رշ�Һ©���Ļ������ٽ��������������Ͽڷų���
��4����Ӧ�����ҺҪ�������ϴ�ӣ���ϴ�Ӳ����У���һ��ˮϴ����ҪĿ���dz�ȥ�ִ�������Ͳ���δ��Ӧ�Ĵ���ñ���̼��������Һ�ȿ��Գ�ȥδϴ���Ĵ��ᣬҲ���Խ��������ܽ�ȣ����ñ���ʳ��ˮϴ�ӣ���ҪĿ���dz�ȥ��Ʒ�ϲ�����̼�����ƣ����������20mL 5��̼��������Һϴ�ӵ������dz��ִ���С���ݡ�
��5��������֪��Ϣ����������������ˮCaCl2��Ӧ��������ȵó��𰸡�
��6��n(����)=9.0g��60g/mol=0.15mol��n(���촼) =6.6g��88g/mol=0.075mol�����ڶ��߷�Ӧʱ��1:1��Ӧ�ģ������������Ҫ���մ������㡣n(����������)=5.2 g��130g/mol=0.04mol�����Ա�ʵ��IJ�����0.04mol��0.075mol��100�G=53.3�G��
��7����Ϊ�������С�մ�Ӧ�������ӻ���������ɣ����������Ч���������������촼�������Ϊ������Ч�����Ǻܺá�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�ĵ絼��Խ��������Խǿ����0.100 mol��L1��NaOH��Һ�ֱ�ζ�10.00 mLŨ�Ⱦ�Ϊ0.100 mol��L1 �������CH3COOH��Һ�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ����
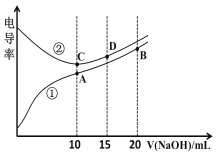
A�������������ζ�HCl��Һ������
B��A����Һ�У�c(CH3COO)+c(OH)c(H+)=0.1 molL1
C������ͬ�¶��£�A��B��C������Һ��ˮ�ĵ���̶ȣ�C��B��A
D��D����Һ�У�2c(Na+)=3c(Cl)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ������������Ҫ�������£�
���ڼ��Թܣ���ͼ���м���2mLŨ���ᡢ3mL�Ҵ���2mL����Ļ����Һ��
�ڰ���ͼ���Ӻ�װ�ã�װ�����������ã���������Һ����С����ȵؼ���3��5min��
�۴��Թ����ռ���һ���������ֹͣ���ȣ������Թ��Ҳ�������Ȼ���ô��ֲ㡣
�ܷ�������������㡢ϴ�ӡ����
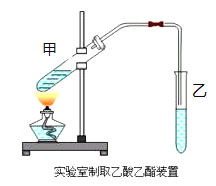
��1��д����ȡ���������Ļ�ѧ����ʽ��___________________________________��
��2���ڷ�Ӧδ��ʼǰ�����Թ�����ʢ��ҺΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪͭпԭ���ʾ��ͼ�����й���пͭԭ��ص�˵����ȷ���ǣ�������

A. ���������ķ�Ӧ�ǣ�2H+ +2e��=H2��
B. ��Һ��SO42-��ͭƬ�ķ����ƶ�
C. ��װ��ʵ���˻�ѧ��ת��Ϊ����
D. ������0.2mol H2,����6.5��п����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֱ���������ϡ���������������Һ��Ӧ����������Ӧ�ų�����������ͬ״����������ʱ����Ӧ�����ĵ�HCl��NaOH�����ʵ���֮����
A��1��1 B��2��1 C��1��3 D��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A2On2-����B2-��Ӧ��B2-������������ΪB���ʣ�A2On2-����ԭ������ΪA3+����֪100 mL c��A2On2-��= 0��3 mol/L����Һ��150 mL c��B2-��= 0��6 mol/L����Һǡ����ȫ��Ӧ����nֵΪ�� ��
A��4 B��5 C��7 D��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2���������ӻ�Ӿ�����ЧӦ��Ϊ�������ŷţ��轫��ҵ�����в�����CO2����������д�������á�
��1��CO2��NH3��Ӧ�ɺϳɻ�������[��ѧʽΪCO(NH2)2]��
��֪��
��2NH3(g)��CO2(g)=NH2CO2NH4(s) ��H=��159.5kJ/mol
��NH2CO2NH4(s)=CO(NH2)2(s)��H2O(g) ��H=��116.5kJ/mol
��H2O(l)=H2O(g) ��H=��44.0kJ/mol
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ��______________��
��2��CO2��H2Ҳ�����ںϳɼ״���CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ�������ѹǿΪPʱ���÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ����ƽ��ʱCO2��ת������ͼһ��ʾ��
CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ�������ѹǿΪPʱ���÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ����ƽ��ʱCO2��ת������ͼһ��ʾ��
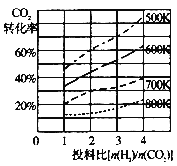
ͼһ ͼ�� ͼ��
���÷�Ӧ��S 0��H 0���������������
��700Kʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP= ��
�����¶Ȳ��䣬��С��Ӧ��Ͷ�ϱ�[n(H2)/n(CO2)]��Kֵ �����������С�����䡱����
��700KͶ�ϱ�[n(H2)/n(CO2)] = 2ʱ����ƽ��ʱH2��ת����Ϊ ��
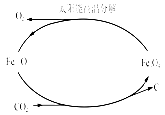
��3������̫���ܺ�ȱ��������[��Fe0.9O]�ɽ�������������CO2�Ƚ�Ϊ̼��������ʵ��CO2����Դ����ת��������ͼ����ʾ������1molȱ��������[Fe0.9O]������CO2��ȫ��Ӧ������ molC(̼)��
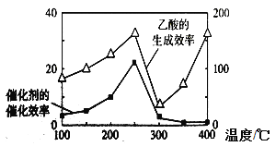
��4����TiO2/Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ������ν���ͼ��250-400��ʱ�¶�������������������ʱ仯�Ĺ�ϵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾˮ��c(H+)��c(OH-)�Ĺ�ϵ�������жϴ������

A. XZ���������������ԣ�pH��7
B. ����������������c(H+)��c(OH-)��Kw
C. M��������������c(H+)<c(OH-)
D. ͼ��T1<T2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���1mol H2��11.2 L O2��ϣ��õ���������Ϊ( )
A��12.2 L B��<22.4 L C��33.6 L D����ȷ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com