
【题目】在一恒定的容器中充入2molA和1molB发生反应:2A(g)+ B(g)![]() xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
A. 只能为2 B. 只能为3
C. 可能是2,也可能是3 D. 无法确定
【答案】C
【解析】根据题意,这两平衡为等效平衡。
等效平衡有两种类型(对于可逆反应:mA(g)+ nB(g)![]() pC(g)+ qD(g)):
pC(g)+ qD(g)):
Ⅰ类恒温恒容:①若m + n =" p" + q,只要“极限转换”后,与原起始物质的物质的量(或浓度)相等,就可以达到相同平衡状态。②若m + n![]() p + q,只要“极限转换”后,对应物质的物质的量之比相等,就可达珐相同的平衡状态。
p + q,只要“极限转换”后,对应物质的物质的量之比相等,就可达珐相同的平衡状态。
Ⅱ类恒温恒压:只要“极限转换”后,对应物质的物质的量之比相等,就可达到相同的平衡状态。
本题属于Ⅰ类(恒温恒容),由于已知方程式中x未知,故有两种可能:一是x![]() 3(即系数不等),二是x = 3(即系数相等)。
3(即系数不等),二是x = 3(即系数相等)。
若x![]() 3,2A(g) + B(g)
3,2A(g) + B(g)![]() xC(g)
xC(g)
2 1 0
0.6 0.3 1.4
极限换算![]()
![]() 0
0
![]() 依题意可得:
依题意可得:![]() = 2
= 2
![]() = 1
= 1
解得:x =" 2" 符合题意。
若X = 3,则(![]() ):(
):(![]() )=(
)=(![]() ):(
):(![]() )=4.6:2.3=2:1。符合题意。
)=4.6:2.3=2:1。符合题意。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列制备金属单质的方法或原理正确的是 ( )。
A. 在高温条件下,用H2还原MgO制备单质Mg
B. 在通电条件下,电解熔融Al2O3制备单质Al
C. 在通电条件下,电解饱和食盐水制备单质Na
D. 加强热,使CuO在高温条件下分解制备单质Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池示意图,下列关于锌铜原电池的说法正确的是( )

A. 负极发生的反应是:2H+ +2e—=H2↑
B. 溶液中SO42-向铜片的方向移动
C. 该装置实现了化学能转化为电能
D. 若生成0.2mol H2,则有6.5克锌被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A2On2-可与B2-反应,B2-被氧化,产物为B单质,A2On2-被还原,产物为A3+;且知100 mL c(A2On2-)= 0.3 mol/L的溶液与150 mL c(B2-)= 0.6 mol/L的溶液恰好完全反应,则n值为( )
A.4 B.5 C.7 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2]。
已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式:______________。
(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中压强为P时,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图一所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中压强为P时,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图一所示。
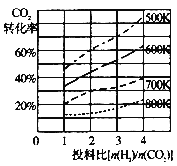
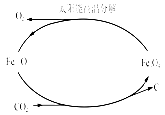
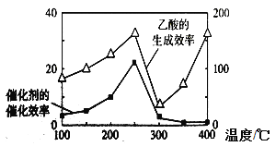
图一 图二 图三
①该反应的S 0,H 0(填“>”或“<”)。
②700K时,用平衡分压代替平衡浓度表示的化学平衡常数KP= 。
③若温度不变,减小反应物投料比[n(H2)/n(CO2)],K值 (填“增大”、“减小”或“不变”)。
④700K投料比[n(H2)/n(CO2)] = 2时,达平衡时H2的转化率为 。
(3)利用太阳能和缺铁氧化物[如Fe0.9O]可将富集到的廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图二所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成 molC(碳)。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图三。如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化必须加入氧化剂才能进行的是( )
A. HCO3﹣→CO2 B. MnO4﹣→Mn2+ C. Fe2+→Fe3+ D. Na2O2→O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是

A. XZ线上任意点均呈中性,pH=7
B. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
C. M区域内任意点均有c(H+)<c(OH-)
D. 图中T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法中正确的是( )
A. 电极一定要由两种不同的金属组成
B. 电子流出的一极是正极
C. 两极均发生氧化还原反应
D. 由化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检测某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组设计了如下实验流程:

(1)通入N2的目的是_______________________
(2)第①步反应的离子方程式是______________________
(3)滴定实验若选择酚酞作指示剂,则滴定终点的标志是________滴定过程中以下操作使测定结果偏高的是________(填编号)
a. 洗净的滴定管未用标准液润洗
b. 滴定中向锥形瓶内壁加少量水
c. 滴定前滴定管正常,滴定后尖嘴部分有气泡
d. 锥形瓶用待测液洗涤2-3次
(4)若实验室欲制取SO2可选用试剂__________(填编号)
a. 铜和浓硫酸 b. 硫和氧气
c. 亚硫酸钠和浓度70%的硫酸 d. 亚硫酸钙和硝酸
(5)往BaCl2溶液中通入SO2至饱和,无明显现象,再通入NH3后出现白色沉淀,此时溶液中一定有的溶质是_________。请用电离平衡解释上述实验现象:_________________
(6)H2O2是一种绿色氧化剂。某NH4Cl样品中含少量Fe2+、SO42-,将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,即得到工业氯化铵。
滤渣的主要成分是_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com