
| A. | 1molH2O含有的H2O分子数为NA | |
| B. | 1mol金属镁与足量的盐酸完全反应,转移的电子数为2NA | |
| C. | 11.2L氧气含有的O2分子数为0.5NA | |
| D. | 将含1molFeCl3的溶液与沸水完全反应,生成的Fe(OH)3胶体粒子数为NA |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:多选题
| A. | 离子半径:Na+>Al3+ | |
| B. | 铝钠合金若投入一定水中可得无色溶液并产生气泡 | |
| C. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| B. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴单质 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 蒸馏操作时,应向蒸馏烧瓶中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
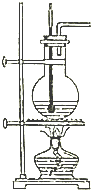 实验室用如图所示装置制取乙烯,请回答下列有关该实验的问题:
实验室用如图所示装置制取乙烯,请回答下列有关该实验的问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com