
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 用容量瓶配制溶液时,定容后摇匀 | 液面低于刻度线 | 浓度一定偏高 |
| B | 燃着的镁条深入盛CO2的集气瓶中 | 镁条继续燃烧 | 镁有比较强的还原性 |
| C | 分别向酸性KMnO4溶液中加入FeCl2或通入SO2 | 酸性KMnO4溶液颜色均褪去 | Fe2+具有还原性,SO2具有漂白性 |
| D | 过量Fe粉加入稀HNO3中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.摇匀后部分溶液留在刻度线上方,导致液面低于刻度线,对溶液浓度没有影响;
B.根据氧化还原反应中化合价变化判断氧化性、还原性;
C.酸性高锰酸钾溶液具有强氧化性,能够氧化二氧化硫、亚铁离子;
D.过量Fe粉加入稀HNO3中,充分反应后生成亚铁离子,滴入硫氰化钾后不会变红色.
解答 解:A.用容量瓶配制溶液时,定容后摇匀,摇匀刻度线上方有残留溶液,导致液面低于刻度线,属于正常现象,对溶液浓度没有影响,故A错误;
B.燃着的镁条深入盛CO2的集气瓶中,镁条继续燃烧生成氧化镁和碳,证明金属Mg的还原性较强,故B正确;
C.分别向酸性KMnO4溶液中加入FeCl2或通入SO2,亚铁离子、二氧化硫被酸性高锰酸钾溶液氧化,导致酸性KMnO4溶液颜色均褪去,二氧化硫没有表现漂白性,故C错误;
D.过量Fe粉加入稀HNO3中,充分反应后生成硝酸亚铁,滴入KSCN溶液后溶液没有明显现象,故D错误;
故选B.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,涉及溶液配制、氧化性、还原性强弱比较、铁离子、亚铁离子的检验方法,明确常见元素及其化合物性质为解答关键,试题培养了学生的化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 产生的气体溶于水中,能使酚酞变红 | |
| B. | 催化剂保持红热 | |
| C. | 可能生成红棕色的气体 | |
| D. | 可能产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
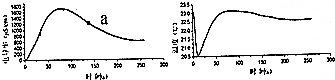
| A. | 冰醋酸稀释过程中,溶液的导电能力先增大后减小 | |
| B. | 左图的曲线也可以表示溶液的pH变化趋势 | |
| C. | 稀释一开始,溶液的温度就下降,可推知电离过程可能是吸热过程 | |
| D. | 可通过微热的方法,使图中a点溶液中的c(CH3COO-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
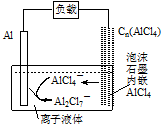 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 充电时,阴极发生:4Al2Cl7-+3e-═Al+7AlCl4- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,负极发生:2AlCl4--e-═Al2Cl7-+Cl- | |
| D. | 放电时,电路中每流过3mol电子,正极减少27g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力推广燃煤发电以满足工业发展的用电需求 | |
| B. | 加强生活污水的除磷处理,遏制水体的富营养化 | |
| C. | 实施化石燃料脱硫硝技术,减少大气污染物的排放 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
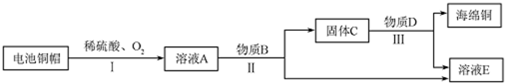
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com