
A、 蒸发、结晶、浓缩 |
B、 检查装置气密性 |
C、 碳酸氢钠受热分解 |
D、 分离沸点不同且互溶的液体混合物 |


科目:高中化学 来源: 题型:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯的硝化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 |
| B、C8H10含苯环的烃同分异构体有3种 |
| C、乙烯、苯、乙烷分子中的所有原子都在同一平面上 |
D、莽草酸( )能使溴的四氯化碳溶液褪色 )能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向1 mo1?L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | ||||||||||
B、25℃时,将a mo1?L-l氨水与0.01 moI?L-1盐酸等体积混合,反应完全时溶液中Kb=
| ||||||||||
C、根据下表数据可以计算出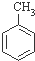 (g)+3H2(g)→ (g)+3H2(g)→ (g)的焓变 (g)的焓变
| ||||||||||
| D、已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol?L-1,c(CO32-)=0.0001 mol?L-1,此时Mg2+和CO32-不能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先后通入溴水和澄清的石灰水 |
| B、点燃后罩上涂有澄清石灰水的烧杯 |
| C、点燃后罩上涂有澄清石灰水的烧杯,通入溴水 |
| D、点燃,先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向鸡蛋白溶液中滴入HgCl2溶液 | 有白色沉淀 | 蛋白质发生盐析 |
| B | 向溶液X中滴加BaCl2溶液 | 有白色沉淀 | X中一定含有SO42- |
| C | AgCl饱和溶液中加入少量NaI溶液 | 产生黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐退去 | Na2CO3溶液中存在水解平衡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol |
| B、0.2mol |
| C、0.25mol |
| D、0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com