
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)(mol) | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)(mol) | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:| A.③④ | B.②③ | C.①④ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2(g) + Ca(OH)2 = CaCO3↓ + H2O |
B.H2 + I2 2HI 2HI |
| C.NaCl +AgNO3 = AgCl↓ + NaNO3 |
D.N2 +3H2 2NH3 2NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求:
CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.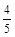 υ(NH3) =υ(O2) υ(NH3) =υ(O2) | B.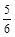 υ(O2) =υ(H2O) υ(O2) =υ(H2O) |
C.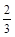 υ(NH3) =υ(H2O) υ(NH3) =υ(H2O) | D.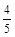 υ(O2) =υ(NO) υ(O2) =υ(NO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com