
| A、pH=3的盐酸和pH=11的氨水等体积混合 |
| B、pH=1的硫酸和0.2 mol/L的氢氧化钠溶液等体积混合 |
| C、pH=3的醋酸和 pH=11 的氢氧化钠溶液等体积混合 |
| D、0.1 mol/L的硫酸和0.2 mol/L的氨水等体积混合 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、在吸热反应中,反应物的总能量比生成物的总能量高 |
| B、应用盖斯定律可以计算某些难以测量的反应焓变 |
| C、需要加热的化学反应都是吸热反应 |
| D、盐类的水解反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、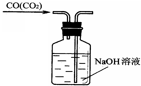 |
B、 |
C、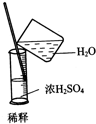 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
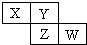 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、次氯酸的电离方程式:HClO?H++ClO- |
| B、铝溶于烧碱溶液的离子方程式:Al+2OH-=AlO2-+H2↑ |
| C、电解精炼铜的阴极反应式:Cu-2e-=Cu2+ |
| D、已知中和热为57.3 kJ?mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=-57.3 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
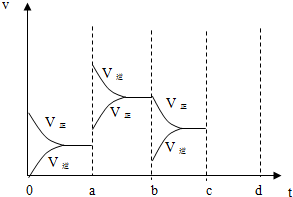
查看答案和解析>>
科目:高中化学 来源: 题型:
 80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:
80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.04 | 0.28 | 0.20 | a | b | c |
| n(NO2) | 0.00 | 0.24 | 0.40 | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com