
1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
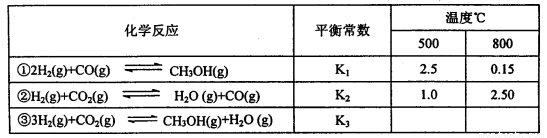
(1)反应②是____________(填“吸热”或“放热”)反应。
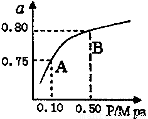
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示
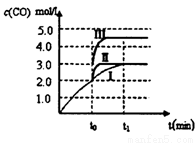
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如下图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,
以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
(5)一定条件下甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_____________。
(1)吸热(2分) (2) = (2分) K1·K2 (2分)
(3)加入催化剂(2分); 将容器的体积(快速)压缩至2L(2分,仅答“加压”给1分)
(4) CH3OH-6 e-+8 OH-=CO32-+6 H2O;
(5)  ×10-7 (3分)
×10-7 (3分)
【解析】
试题分析:(1) 反应②随着温度的升高K增大,故正反应为吸热反应;
(2)平衡常数只随温度变化,与压强无关,平衡常数K(A)=K(B);据反应①+②=③可推导反应物质的浓度在K中是幂之积的关系,即K3=K1·K2。
(3)曲线Ⅰ变为曲线II时,反应速率加快,而c(CO)平衡浓度不变,改变的条件是加入催化剂;曲线Ⅰ变为曲线III时,反应速率加快,c(CO)平衡浓度增加,改变的条件是将容器的体积(快速)压缩至2L(仅答“加压”不准确)
(4) 甲醇是该碱性燃料电池的负极,失去电子,反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O ;
(5)将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-)=2b mol/L,由电荷守恒得出c(H+)=c(OH-)= 10-7 mol/L;因CH3COOH CH3COO-+H+,醋酸的电离常数为
CH3COO-+H+,醋酸的电离常数为
考点:化学反应速率与平衡、原电池的电极反应式。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:选择题
根据表中信息,判断下列叙述中正确的是
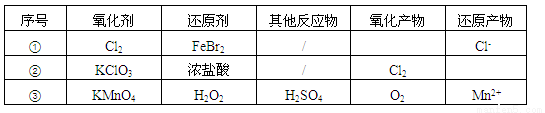
A.表中①组的反应只可能有一种元素被氧化和一种元素被还原
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:选择题
鉴别二甲醚和乙醇可采用化学方法或物理方法,下列方法不能对二者进行鉴别的是
A.利用金属钠或金属钾法 B.利用红外光谱法
C.利用质谱法 D.利用核磁共振氢谱法
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知室温时,0.1mo1/LCH3COOH在水中有0.1%发生电离,下列叙述正确的是:
A.该溶液的pH=5
B.由CH3COOH电离出的c(H+)约为水电离出的c(H+)的106倍
C.CH3COOH的电离平衡常数约为1×10-6
D.升高温度,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.分子式为C3H8与C6H14的两种有机物一定互为同系物
B.具有相同通式的有机物不一定互为同系物
C.分子式C4H10表示的物质必是纯净物
D.有机物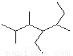 的名称:2,3,5-三甲基-4-乙基庚烷
的名称:2,3,5-三甲基-4-乙基庚烷
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省安阳市高三毕业班第二次模拟理综化学试卷(解析版) 题型:选择题
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH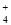 )之和
)之和
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省商丘市高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
(12分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:

①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是 ;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是 。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O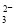 =2I-+S4O
=2I-+S4O ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
实验序号 | 1 | 2 | 3 |
Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
则该产品的纯度是____ ,间接碘量法滴定过程中可能造成实验结果偏低的是____ 。
A.滴定管末用Na2S2O3溶液润洗 B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗 D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:选择题
CO(g)+H2O(g)  H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
A.加入催化剂,改变了反应的途径,反应放出的热量也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:选择题
已知反应: 为放热反应,一定温度下在密闭容器中进行反应,
为放热反应,一定温度下在密闭容器中进行反应,
下图是该反应达平衡及改变条件平衡移动的图像。下列说法正确的是

A.图中的a、b、c、d都是平衡点
B.起始时,加入Y的物质的量为1.3 mol ,
C.c点和d点表示正反应速率大于逆反应速率
D.在3 MPa和1 MPa条件下,反应达平衡时,放出的热量:Q(A)>Q(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com