
CO(g)+H2O(g)  H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
H2(g)+CO2(g) △H<0,在其他条件不变的情况下,下列说明正确的是
A.加入催化剂,改变了反应的途径,反应放出的热量也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2013-2014河南省安阳市高三毕业班第二次模拟理综化学试卷(解析版) 题型:简答题
1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
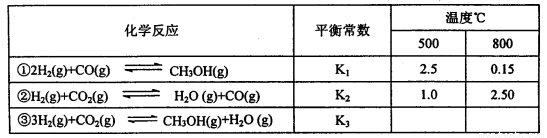
(1)反应②是____________(填“吸热”或“放热”)反应。
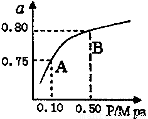
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示
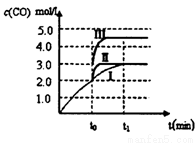
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如下图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,
以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
(5)一定条件下甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省商丘市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度,延长食品保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:实验题
控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
实验 序号 | 碳酸钙状态 | c(HCl)/mol·L-1 | 溶液温度/oC | 碳酸钙消失时间/s | |
反应前 | 反应后 | ||||
1 | 粒状 | 0.5 | 20 | 39 | 400 |
2 | 粉末 | 0.5 | 20 | 40 | 60 |
3 | 粒状 | 0.6 | 20 | 41 | 280 |
4 | 粒状 | 0.8 | 20 | 40 | 200 |
5 | 粉末 | 0.8 | 20 | 40 | 30 |
6 | 粒状 | 1.0 | 20 | 40 | 120 |
7 | 粒状 | 1.0 | 30 | 50 | 40 |
8 | 粒状 | 1.2 | 20 | 40 | 90 |
9 | 粒状 | 1.2 | 25 | 45 | 40 |
分析并回答下列问题:
(1)本反应属于__________反应(填“吸热”或“放热”),反应的离子方程式_____________。
(2)实验6和7表明,___________对反应速率有影响,__________反应速率越快,能表明同一规律的实验还有_____________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是_____________________。
(4)本实验中影响反应速率的其它因素还有________________,能表明这一规律的实验序号是1、2与____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:选择题
某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是

A.如图条件下实验过程中没有热量损失
B.若改用60ml0.50mol/L盐酸跟50ml0.55mol/L的NaOH溶液进行反应,通过测定反应过程中所放出的热量相等
C.图中实验装置缺少环形玻璃搅拌棒
D.烧杯间填满碎纸条的作用是固定小烧杯。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:填空题
按要求完成下列问题:
(1)某有机物的键线式是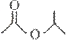 ,请写出它与NaOH溶液反应的化学方程式___________:
,请写出它与NaOH溶液反应的化学方程式___________:
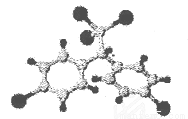
(2)DDT人类合成的第一种有机氯农药,其分予结构球棍模型如图所示。请分析该物质的核磁共振'H谱图中有____________个吸收峰。
(3)F和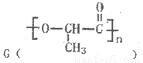 是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
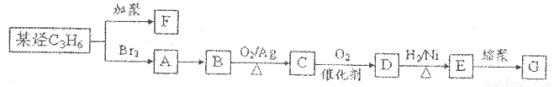
请回答下列问题:
①F的结构简式为____________
②C中所含官能团的名称为________。用____________仪可以测定D中所舍官能团。
③A→B的化学方程式为__________________________________________________。

请参考题目中的合成途径,若合成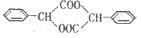 ,起始原料的某烃的结构简式
,起始原料的某烃的结构简式
为_________,最少用____________步反应,可以合成产物。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:选择题
下列说法正确的是;
A.用石墨作电极,电解1mol/LNa2CO3的溶液,溶液的pH值保持不变
B.非金属元素呈现的最高化合价不超过该元素的最外层电子数
C.含8gNaOH的溶液中通入一定量的H2S后,将所得溶液小心蒸干,得无水物7.9g,则该无水物中一定含有Na2S
D.使用清洁的天然气是快速、有效地减缓大气中二氧化碳大量增加的生态学措施
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期5月联考化学试卷(解析版) 题型:选择题
W、X、Y、Z是短周期元素,其部分性质如下表

下列说法正确的是
A.气态氢化物的热稳定性:X>W B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W D.Z的氧化物中含有非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com