
【题目】含有一个碳碳双键的烯烃,加氢后产物的结构简式为如图,这种烯烃可能的结构有(不考虑立体异构)( )
![]()
A. 5种B. 6种C. 7种D. 8种
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类可持续发展面临的重要问题,某科学家设计的UT-3热化学循环如下图所示:
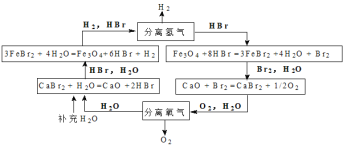
该过程最终制得的能源气体是
A.H2B.O2C.HBrD.Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱土金属指元素周期表中第ⅡA族元素,它们的单质和化合物用途较为广泛。
(1)铍元素能形成一种价格昂贵的宝石——祖母绿,其化学式为Be3Al2(SiO3)6,其中铍元素的化合价是________,基态铍原子的价电子排布式为________。
(2)镁是航天工业的重要材料。镁元素和相邻元素钠、铝的第一电离能的大小顺序为________。
(3)钙元素在自然界以化合物CaCl2、CaCO3、CaSO4、Ca(OH)2等形式存在。上述四种物质中只含有一种类型化学键的是________;CO32-的中心原子的杂化类型是________,空间构型是________。

(4)钡元素与氧元素能够形成一种化合物,其晶胞结构如图所示,该物质的化学式为________,Ba2+的配位数是________,若阿伏加德罗常数的值为NA,晶胞边长为a cm,则晶体的密度为________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图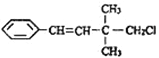 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )
A. 一定条件下,能发生加聚反应
B. 1mol该有机物在一定条件下最多能与4molH2发生反应
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 该有机物苯环上的一溴代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)三大合成材料______、______、______。
(2)下列有机物中属于脂肪烃的是______;属于芳香烃的是_____;属于苯的同系物的是______;属于脂环的是________。(填序号)
① ②
②![]() ③
③ ④
④![]() ⑤
⑤ ⑥
⑥
(3)实验室制取乙烯所用的乙醇为无水乙醇,但工业酒精中乙醇的含量为95%,将工业酒精转化为无水乙醇的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿(主要成分是二氧化锰)制高锰酸钾的流程如下(部分条件和产物省略):
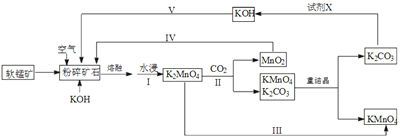
请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有______________________。
(2)写出向二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:___________________________________。
(3)从经济性考虑试剂X宜选择(填名称):___________。上述流程中,设计步骤IV和V的目的是____________________________________。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为___________________。
②电解过程中,阴极附近电解质溶液的pH将_______(填:增大、减小或不变)。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色时,达到滴定终点。写出离子方程式:__________________。
(6)已知:常温下,Ksp [Mn(OH)2]=2.010-13。工业上,调节pH沉淀废水中Mn2+。当pH=10时,溶液中c(Mn2+)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIO3是强酸,其水溶液是强氧化剂。工业上,以KIO3为原料可制备HIO3。某学习小组拟用如图装置制备碘酸。M、N为惰性电极,ab、cd为交换膜。下列推断错误的是( )
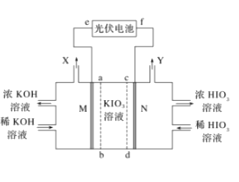
A.光伏电池的e极为负极,M极发生还原反应
B.在标准状况下收集6720mLX和Y的混合气体时KIO3溶液减少3.6g
C.Y极的电极反应式为2H2O-4e-═O2↑+4H+
D.制备过程中要控制电压,避免生成HIO4等杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com