(2011?湖北模拟)X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
①它们核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③X和N都由A、C两元素组成,X和Y核内质子数相等;
④Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
⑤Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的.
根据以上信息,请回答下列问题:
(1)Y的化学式为
H3O+
H3O+
,X的电子式为
.
(2)试比较M和N的稳定性:M
>
>
N(填“>”、“<”、“=”)
(3)检验X的方法是
用试管取含X的溶液少量,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
用试管取含X的溶液少量,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
.
(4)由A、B、C三种元素组成的物质中,属于离子化合物的有
NH4NO3等
NH4NO3等
,属于共价化合物的有
HNO3等
HNO3等
(各任写一种物质的化学式)
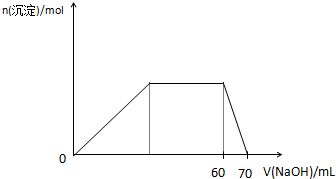
(5)上述六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如图,则该复盐的化学式为
(NH4)3Al(SO4)3或3(NH4)2SO4﹒Al2(SO4)3
(NH4)3Al(SO4)3或3(NH4)2SO4﹒Al2(SO4)3
.



 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案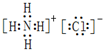
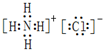


 (2011?湖北模拟)X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
(2011?湖北模拟)X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
