
����Ŀ����̼���ء��顢���Ļ����ﱻ�㷺Ӧ�����²����Ʊ�������������������������ʽṹ���֪ʶ���ش��������⣺
��1�����������ء��顢������Ԫ���У���һ�������ɴ�С˳��Ϊ___���縺���ɴ�С˳��Ϊ___����Ԫ�ط�����д��
��2��Ԫ�ص�����ͬ�塣��̬��Ԫ�صļ۵����Ų�ʽΪ___��Ԥ������⻯����ӵ�����ṹΪ___����е��NH3��___����ߡ��͡��������ж�������___��
��3��������Ӧ�ù㷺����֪BP���۵�ܸߣ��侧���ṹ��ͼ��ʾ��
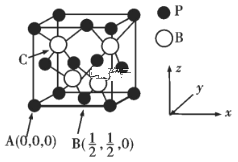
C���ԭ������Ϊ___��Bԭ����Pԭ�ӵ��������Ϊdpm��������ܶ�Ϊpg/cm3��NA���������ӵ�������ֵ������=___g/cm3���ú�d��NA�Ĵ���ʽ��ʾ��
���𰸡�As>Se>Ga Se>As>Ga 2s22p3 ������ �� NH3���Ӽ������� ��![]() ��
��![]() ��
��![]() ��
�� 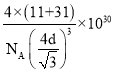
��������
��1��ͬ����Ԫ�صĵ�һ��������ԭ��������������������������Ӵ��ڰ����״̬�����һ�����ܴ�������Ԫ�أ�ͬ����Ԫ�صĵ縺����ԭ�����������������
��2���黯���백��Ϊ�ȵ����壻�������Ӽ������������黯����Ӽ��������
��3��������=m/V���㡣
��1�����������ء��顢���ֱ�ΪIIIA�塢VA�塢VIA��Ԫ�أ�ͬ����Ԫ�صĵ�һ��������ԭ��������������������������Ӵ��ڰ����״̬�����һ�����ܴ�������Ԫ�أ����һ�������ɴ�С��˳��ΪAs>Se>Ga��ͬ����Ԫ�صĵ縺����ԭ�������������������縺���ɴ�С˳��ΪSe>As>Ga��
��2����Ԫ��λ�ڵڶ�����VA��Ԫ�أ����̬��Ԫ�صļ۵����Ų�ʽΪ2s22p3���黯���백��Ϊ�ȵ����壬����Ϊ�����Σ����黯��Ϊ�����Σ��黯��ķе�Ȱ����ͣ��������Ӽ���������ʹ���Ӽ�������������۷е����ߣ����黯����Ӽ��������
��3��C���ڶ����붥�����ڵ�3����������ϵ�Pԭ�ӹ��ɵ�������������ģ���C�������Ϊ��![]() ��
��![]() ��
��![]() ����һ�������к���P�ĸ���=8��
����һ�������к���P�ĸ���=8��![]() +6��
+6��![]() =4��Bԭ���ھ��������ڣ�����Ϊ4�����ݾ����Ľṹ��Bԭ����Pԭ�ӵ��������Ϊ��Խ��ߵ�1/4����Խ���=4dpm���ⳤ=
=4��Bԭ���ھ��������ڣ�����Ϊ4�����ݾ����Ľṹ��Bԭ����Pԭ�ӵ��������Ϊ��Խ��ߵ�1/4����Խ���=4dpm���ⳤ=![]() pm������=m/V=��11+31����4/
pm������=m/V=��11+31����4/![]() =
=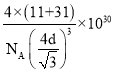 g/cm3��
g/cm3��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ClO3���Ŀռ乹��Ϊƽ��������B. SF6����6����ͬ�ijɼ����Ӷ�
C. �����������ʲ���ֻ�������������ȶ�D. SiF4��SO32��������ԭ�Ӿ�Ϊsp2�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӧ����2FeCl3+2KI===2FeCl2+2KCl+I2����2Fe+3Cl2![]() 2FeCl3����2KMnO4+16HCl(Ũ)===2KCl+2MnCl2+8H2O+5Cl2������ij��Һ����Fe2+��I��Cl��Ҫ������ȥI������ȥFe2+��Cl���ɼ�����Լ���
2FeCl3����2KMnO4+16HCl(Ũ)===2KCl+2MnCl2+8H2O+5Cl2������ij��Һ����Fe2+��I��Cl��Ҫ������ȥI������ȥFe2+��Cl���ɼ�����Լ���
A. Cl2B. KMnO4C. FeCl3D. HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪4NH3+5O2�T4NO+6H2O����Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ����ȷ���ǣ� ��
A.4/5v(O2)= v(NO)
B.5/6v(O2)= v(H2O)
C.2/3v(NH3)= v(H2O)
D.4/5v(NH3)= v(O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A��C��H��O����Ԫ����ɣ���Է�������Ϊ90����4.5 g A��ȫȼ�յIJ�������ͨ��������Ũ����ͼ�ʯ�ң��ֱ�����2.7 g��6.6 g��A����NaHCO3��Һ����CO2����������A֮����ˮ��������Ԫ��״������й�A��˵����ȷ����
A. �л���A�ķ���ʽΪC3H8O3
B. 0.1 mol A������Na��Ӧ����2.24 L H2
C. A�������IJ��ﲻ�ܷ���������Ӧ
D. A����һ�������·������۷�Ӧ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. ![]() �ķ���ʽΪC17H24O3
�ķ���ʽΪC17H24O3
B. ��������Һ��ͨ������������̼���ɱ��Ӻ�̼����
C. �л�����ѣ�HO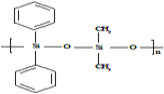 H�����ɵ���
H�����ɵ���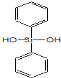 ��
�� ���۶���
���۶���
D. �������ļ״�����ȩ��������ȫȼ��ʱ�ĺ�������ȩ���ĵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3+��SO2��ij��ѧ�о���ѧϰС������ͼ��ʾװ�ý���ʵ�飨�г�������A�еļ���װ�����ԣ��������Ѿ�������ϣ���
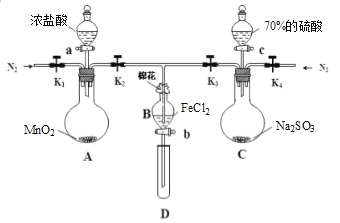
�������ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��������a���μ�һ������Ũ���ᣬ��A������
������B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��������b��ʹԼ2mL����Һ����D�Թ��У��������е���������
�������ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
���������Թ�D���ظ�������������B��Һ�е�������
��1����������Ŀ����__________________________________________________________��
��2�����н������ҺΪ________________��������_____________________________________________ ��
��3��A�з�����Ӧ�Ļ�ѧ����ʽ________________________________________________��
��4�����²���������Һ��Ƶ����ӷ�Ӧ��________________________________________����________��д�Լ���ѧʽ�������������������____________________________________________ ��
��5����˵��������Fe3+��SO2�����ӷ���ʽ��_______________________________��
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������:Cl2��Fe3+��SO2����_______��������������������������
��������B��Һ�к��е����� | ��������B��Һ�к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�л�����ԭ�ϡ��������·�ش�
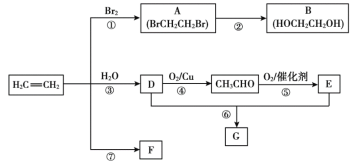
��֪��2CH3CHO+O2����������2CH3COOH
(1)��Ӧ�ٵķ�Ӧ����Ϊ___��B�Ĺ�������___(������)��
(2)��Ӧ�۵Ļ�ѧ����ʽ��___��
(3)F��һ�ָ߷��ӻ��������������ʳƷ������ṹ��ʽΪ___��
(4)G��һ����״������ζ�����ʣ������������Ʒ���
�Ʒ�һ��ʵ������D��E��Ӧ��ȡG��װ����ͼ��ʾ��
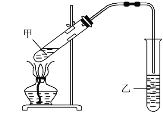
i.��Ӧ�Ļ�ѧ����ʽ��____��
ii.ʵ����þƾ��Ƽ��ȵ�Ŀ����___�����е��Լ�Ϊ___��
�Ʒ�������ҵ����CH2=CH2��Eֱ�ӷ�Ӧ���G��
iii.�÷�Ӧ�ĵĻ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A.ͬ�¡�ͬѹ�£���ͬ���������嶼ռ����ͬ�����
B.ͬ�¡�ͬѹ�£���ͬ��������嶼������ͬ��Ŀ�ķ���
C.ͬ�¡�ͬѹ�£�CH4��O2���ܶ�֮��1��2
D.��0.2gH2��8.8gCO2��5.6gCO��ɻ�����壬�ڱ�״���µ����ԼΪ11.2L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com