
【题目】依据元素周期表和周期律的相关知识,下列说法正确的是( )
A.短周期元素中,原子最外层只有一个或两个电子的元素一定是金属元素
B.I属于副族元素
C.H2S的稳定性比H2O的稳定性强
D.Na、Mg、Al与冷水反应速率逐渐减弱
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】有下列8种晶体,用序号回答下列问题:
A.水晶 B.白磷 C.冰醋酸 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)含有非极性键的原子晶体是_________ ,属于原子晶体的化合物是_______,不含化学键的分子晶体是 _______,属于分子晶体的单质是_________
(2)含有离子键、共价键、配位键的化合物是___________,受热熔化,需克服共价键的是___________.
(3)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有_____个硅原子,______个碳原子;金刚石熔点高于金刚砂的原因_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
A.9种 B.6种 C.5种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的FeCl3溶液,继续煮沸,待溶液呈红褐色停止加热。
①写出该反应方程式________________________________________。
②证明该分散系是胶体最简单的实验操作名称________________________。
(2)对于反应2CO+O2=2CO2,在标准状况下,4.48 L一氧化碳与足量的氧气发生反应,生成的二氧化碳分子个数是__________________。
(3)现有一种泉水样品,1.0 L这种泉水含有4.8×10-2 g Mg2+。那么,该泉水中Mg2+的物质的量浓度是_______________,含1.0 mol Mg2+的这种泉水的体积是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于分离或提纯物质的方法有:过滤、蒸发结晶、蒸馏、萃取、分液、洗气。根据需求填下列装置的序号并填上操作名称:
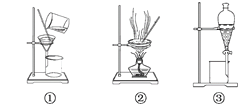
(1)分离Na2CO3溶液和CCl4,选_____,操作名称为________。
(2)用CCl4提取碘水中的碘,选______,操作名称为________。
(3)用氢氧化钠溶液吸收O2中混有的杂质Cl2,选_______,操作名称为________。
(4)除去澄清石灰水中悬浮的CaCO3颗粒选______,操作名称为__________。
(5)制取蒸馏水,选________,操作名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Fe3+、Na+、Cl﹣、OH﹣
B.Fe3+、Cl﹣、K+、Ca2+
C.Cl﹣、Ca2+、Mg2+、CO32﹣
D.Ba2+、K+、CO32﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验科研小组研制了一种从废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)回收镍的新工艺。工艺流程如下图:
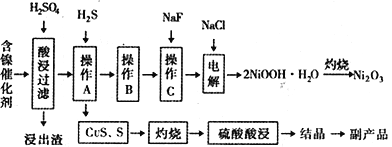
回答下列问题:
(1)浸出渣主要成分为CaSO4↓·2H2O和_______________两种物质。
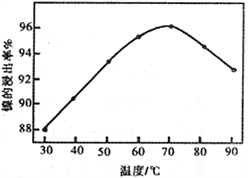
(2)右图表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是_____________________________。
(3)工艺流程中的“副产品”为________(填化学式)。
(4)已知有关氢氧化物开始沉淀和沉淀完全的pH 如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案是否正确进行判断并做出评价: ___________________________________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中![]() =________________。(常温时,Ksp(CaF2)=2.7×10-11)
=________________。(常温时,Ksp(CaF2)=2.7×10-11)
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;生产1mol ClO-,消耗OH-______________mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
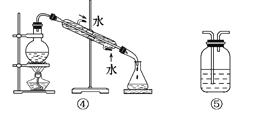
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钠溶液中得到氯化钠固体,选择装置____(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置____;从碘水中提取I2,选择装置____,该分离方法的名称为________。
(2)装置A中①的名称是____________,冷却水的方向是______________,温度计水银球的位置是在_____________;装置B在分液时装置中的液体不能顺利滴下,原因是___________________________。
(3)从碘水中提取碘时,不能选用的试剂是______。
A.酒精 B.苯 C.四氯化碳
若选择试剂X(密度小于水的密度)从碘水中提取碘时,充分振荡、静置后,下层液体的颜色为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com