
【题目】某实验科研小组研制了一种从废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)回收镍的新工艺。工艺流程如下图:
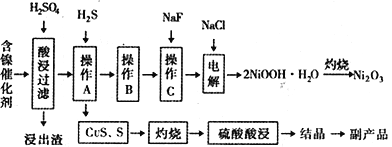
回答下列问题:
(1)浸出渣主要成分为CaSO4↓·2H2O和_______________两种物质。
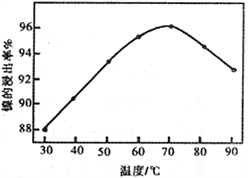
(2)右图表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是_____________________________。
(3)工艺流程中的“副产品”为________(填化学式)。
(4)已知有关氢氧化物开始沉淀和沉淀完全的pH 如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案是否正确进行判断并做出评价: ___________________________________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中![]() =________________。(常温时,Ksp(CaF2)=2.7×10-11)
=________________。(常温时,Ksp(CaF2)=2.7×10-11)
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;生产1mol ClO-,消耗OH-______________mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为_________________________。
【答案】 BaSO4 随着温度升高,Ni2+的水解程度增大(浸出渣中Ni(OH)2含量增大,导致镍的浸出率降低) CuSO4·5H2O 方案错误;在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+ 1.0×10-3 2 ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-
【解析】(1)含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)加入硫酸后生成硫酸盐,其中CaO、BaO加入硫酸后生成微溶的硫酸钙和难溶的硫酸钡,故浸出渣主要成分为CaSO4↓·2H2O和BaSO4两种物质;(2)Ni2+会发生水解反应:Ni2++2H2O![]() Ni(OH)2+2H+,该反应为吸热反应,故温度升高,平衡右移,Ni(OH)2含量增大,镍的浸出率降低;(3)由于CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾,即CuSO4·5H2O;(4)由于用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;(5)根据常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol/L,则Ca2+的浓度为
Ni(OH)2+2H+,该反应为吸热反应,故温度升高,平衡右移,Ni(OH)2含量增大,镍的浸出率降低;(3)由于CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾,即CuSO4·5H2O;(4)由于用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;(5)根据常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol/L,则Ca2+的浓度为![]()
=3×10-6 mol/L,![]() =
=![]() ;(5)Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-。
;(5)Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-。


科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
①流程中先加双氧水的目的是__________________________________________。
②加氨水调节溶液的pH等于6,则滤渣的成分是__________________,滤液中含有的阳离子有H+ 和___________________。
(3)在浸出液里锰元素只以Mn2+ 的形式存在,且滤渣中也无MnO2,请解释原因_________。
(4)阴离子膜法电解装置如右图所示,电解装置中箭头表示溶液中阴离子移动的方向,则A电极是______极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__________________________。

(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表和周期律的相关知识,下列说法正确的是( )
A.短周期元素中,原子最外层只有一个或两个电子的元素一定是金属元素
B.I属于副族元素
C.H2S的稳定性比H2O的稳定性强
D.Na、Mg、Al与冷水反应速率逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)在标准状况下,67.2 L CO2是__________mol,质量为_______g,含有__________个CO2分子,其中含有__________mol氧原子。
(2)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(4)实验室常用浓硫酸的质量分数为98%,密度为1.80 g·mL1,其物质的量浓度是_______。
(5)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:

反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。

①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
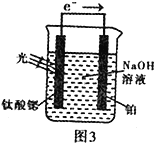
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e-![]() O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Na2CO3溶液显碱性,NaHCO3溶液显酸性
B. 可用加热方法除去NaHCO3固体中的Na2CO3杂质
C. 用Ba(OH)2溶液能鉴别碳酸钠和碳酸氢钠溶液
D. 等质量的Na2CO3、NaHCO3固体分别与足量盐酸反应,后者产生的CO2多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分:

(1)元素③的基态原子轨道表示式为_________________。
(2)元素⑩原子的外围电子排布式为__________。
(3)元素③④⑤的第一电离能由大到小的顺序为___________(填元素符号),其简单离子半径由大到小的顺序为______________(填离子符号)。
(4)⑤与⑧气态氢化物中沸点较高的是_______(填化学式),原因是______________。
(5)以下组合的原子间反应最容易形成离子键的是_____(选填A、B、C、D,下同),最容易形成共价键的是_____,用电子式表示该共价化合物的形成过程______________。
A.和⑤ B.和⑤
C.⑤和⑥ D.⑥和⑧
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_________________________________________________。
(7)根据下列五种元素的第一至第四电离能数据(单位:KJ·mol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是_________(填元素代号)。
②若T为第三周期元素,则T属于________(填“s”、“p”、“d”、“ds”)区元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物属于__(填“共价”或“离子”)化合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com